Le futur de l’épuration extra-rénale
Dr Maxime HOFFMANN
Hôpitaux Privés La Louvière et Villeneuve d’Ascq
Ramsay - Générale de Santé
Si les bases théoriques de la dialyse ont été jetées dès 1861 par un écossais (Graham) avec la découverte des principes de la diffusion et de la membrane semi-perméable, ce n’est qu’en 1911 qu’un américain (Abel) a réalisé la première expérience d’hémodialyse chez le chien, et qu’un allemand (Haas) l’a testé chez l’homme. Diverses évolutions technologiques ont conduit progressivement la technique d’hémodialyse à devenir plus reproductible et plus sûre.
En 2018, dans le Monde, environ 2 millions de patients sont traités par dialyse ou transplantation rénale, ce qui ne représente environ que 10% des besoin réels. En France, environ 43000 patients sont dialysés et 34000 greffés. Dans le Nord-Pas-de-Calais, près de 3500 patients sont dialysés dans des centres répartis sur tout le territoire dans des modalités aussi diverses qu’à domicile (dialyse péritonéale et hémodialyse), en petite unité non médicalisée (autodialyse), ou en des centres avec présence médicale permanente ou non (UDM ou centre lourd). Chaque année et dans notre région, on compte plus de 780 nouveaux patients traités par dialyse. La transplantation rénale ne peut couvrir tous ces besoins (au maximum 200 patients sont greffés dans notre région et les patients sont de plus en plus âgés et malades, c’est-à-dire inéligibles pour une transplantation).
Si la dialyse permet de vivre, elle est une contrainte majeure quotidienne pour tous les patients. Les innovations s’attachent donc à redonner le plus possible de l’autonomie aux patients.
Doivent co-exister au sein de ces innovations deux fonctions minimales d’épuration : une fonction de traitements des déchets (par diffusion ou adsorption) et une fonction de convection - ultra filtration (élimination des liquides surnuméraires).
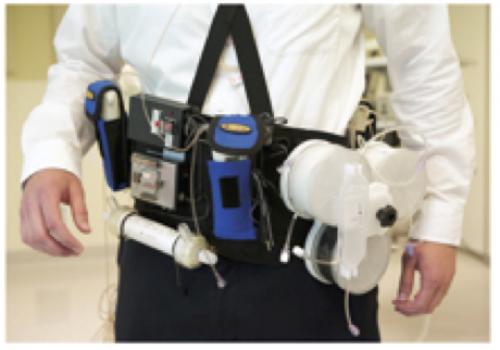
Les progrès techniques et de miniaturisation ont permis de développer des dispositifs portables d’hémodialyse1. Un projet américain est déjà abouti, le WAK (Wearable Artificial Kidney)2. Monté sur une ceinture, ce dispositif de dialyse continue (24h/24) permet, grâce à des cartouches d’adsorbants d’obtenir une épuration de qualité modeste mais satisfaisante. Il a été testé dans le cadre d’un essai clinique portant sur 7 patients avec des résultats positifs. Il reste dans la version actuelle lourd et encombrant, et les développeurs imaginent le rendre à l’avenir plus léger (1kg3). Un projet concurrentiel européen est en train de naître (Nephron+)3. Plus petit, et utilisant les nanotechnologies pour condenser les adsorbants, il utilise le même principe d’hémodialyse continue sur cathéter central. Plus léger, l’objet est aussi connecté et permet de visualiser les performances et les incidents à distance pour y remédier plus rapidement.
1. Wearable Artificial Kidney (Davenport)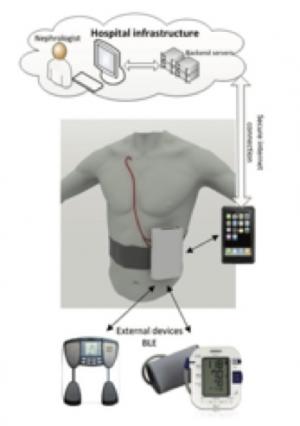 2. Nephron+
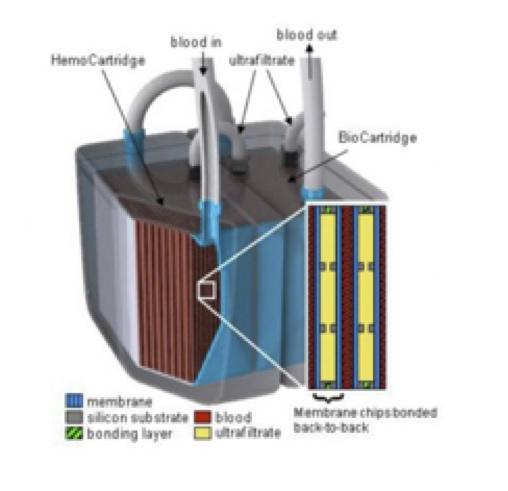
2. Nephron+ Même améliorés, ces dispositifs restent encombrants et peu pratiques. Il apparaissait donc logique de réfléchir à un dispositif implantable de dialyse continue, à l’image du cœur artificiel CARMAT. A l’image d’un authentique greffon, au terme de plus de vingt années d’effort, une équipe américaine a donc conçu un assemblage composite (iRAD - renal assist device) implanté sur les vaisseaux iliaques et la vessie d’un rein artificiel miniature composé d’un compartiment (assez classique) dédié à l’ultrafiltration du plasma du patient via une membrane semi-perméable avec des nanopores plus sélectifs que les membranes actuelles, et d’un bio-réacteur (plus novateur) permettant de retraiter les déchets de cet ultrafiltrat (réabsorbés pour certains et éliminés pour d’autres), composé de cellules tubulaires rénales de cellules humaines prélevés sur des donneurs décédés (impropres à donner un rein entier) greffées et implantées sur des membranes accolées (nanostructures). Ces cellules seraient également capables de sécréter de l’EPO endogène et d’autres facteurs primordiaux de l’homéostasie rénale (et actuellement consommées, lorsqu’elles sont disponibles, par le patient sous formes de comprimés ou d’injection supplémentaires) 4,5.

3. iRAD - Co-existence des deux compartiments.
4. iRAD - Taille comparée
5. iRAD - Schéma interne des compartiments.
Déjà testé chez l’animal, avec un essai chez l’homme sur le court terme dans le traitement d’une insuffisance rénale aiguë, nous sommes en attente d’essais cliniques de l’iRAD dans l’insuffisance rénale terminale qui devraient être lancés cette année. Plus de 9000 patients se sont déjà inscrits comme volontaires pour participer à cette expérimentation.
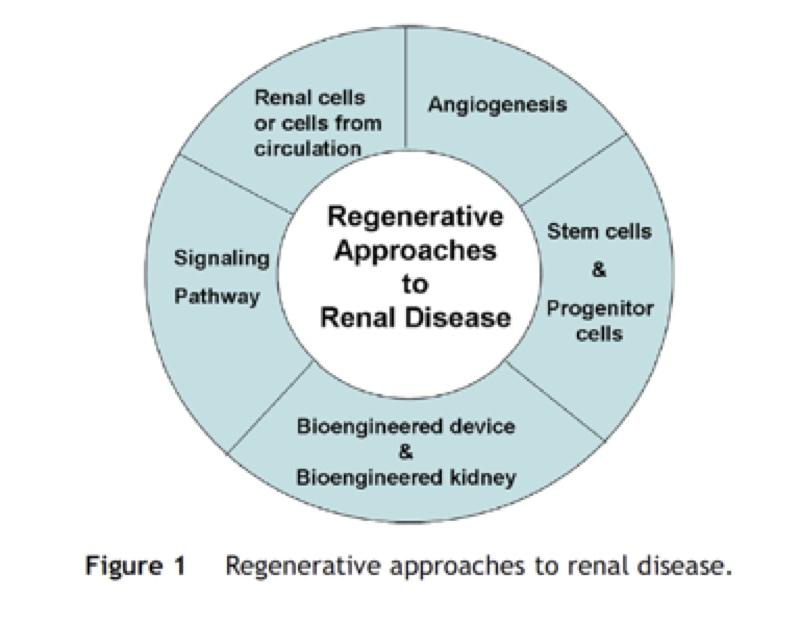
D’autres approches sont également possibles, peut-être plus prometteuses à terme, utilisant des approches innovantes d’ingénierie cellulaire et tissulaire. Trois différentes co-existent. La « rénovation (régénération) rénale » utilise les potentialités des cellules souches dérivées de la moelle osseuse et/ou du rein lui-même afin de réparer in situ l’organe endommagé. Le « rein en culture » consiste à développer in vitro et implanter in vivo un ensemble de néphrons capables d’épurer le sang et de former l’urine. Cette méthodologie nécessite soit l’initiation in vitro de la néphrogenèse, soit la différenciation en cellules rénales de cellules souches pluripotentes autologues (transfert nucléaire, reprogrammation de cellules somatiques). Enfin, la « cooptation rénale » propose de confier aux autres organes ou à la membrane péritonéale ce rôle d’élimination des toxiques et autres déchets métaboliques. La transfection cellulaire in situ et/ou l’implantation de cellules rénales permettraient en effet le développement extra-rénal des fonctions indispensables de transport de solutés et de synthèse hormonale 6.
Pleines de promesses, ces trois stratégies d’ingénierie cellulaire et tissulaire proposent des approches potentiellement complémentaires de remplacement et de maintien de la fonction rénale chez le patient insuffisant rénal. Toutes se heurtent cependant aujourd’hui à différents obstacles méthodologiques, physiopathologiques et éthiques. Leur mise au point nécessite une étroite collaboration entre ingénieurs, embryologistes et néphrologues.
Par soucis de clarté, nous ne nous intéresserons qu’à la régénération (rénovation) rénale.
Historiquement, les travaux de Rosines et al. sont un exemple encourageant d’ingénierie tissulaire de culture » de parenchyme rénal de rat7. Cette méthode reproduit en fait, in vitro, les étapes principales de la néphrogenèse, conduisant, à partir d’un canal de Wolff isolé et de mésenchyme métanéphrique, à la formation d’un tissu de type rénal. Les auteurs en apportent la preuve sur les plans morphologique et fonctionnel. Bien plus, ils montrent que l’implantation in vivo de ces ébauches néphroniques sous la capsule rénale d’un rat entraîne une angiogenèse précoce et l’apparition de structures glomérulaires.
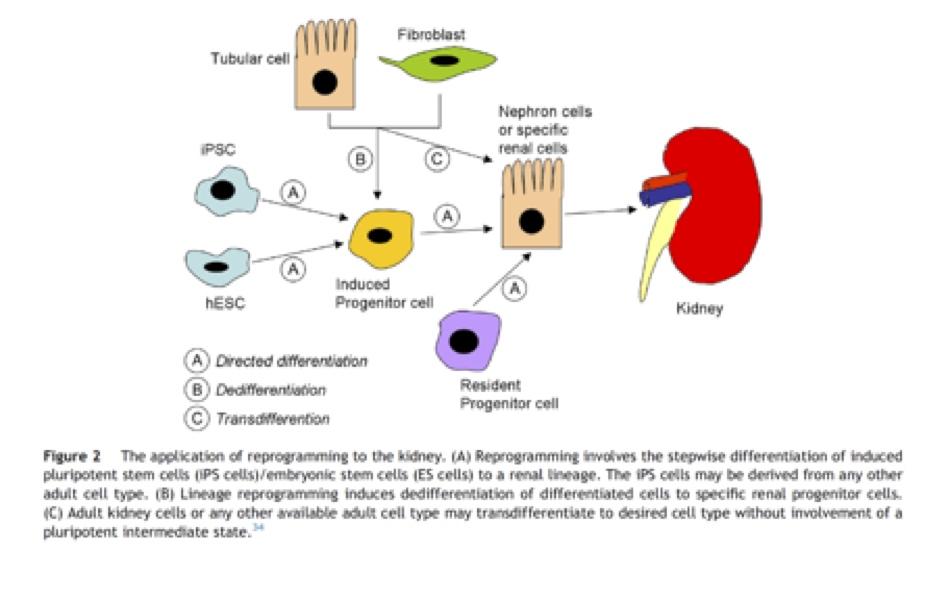
Ces observations ont démontré pour la première fois que la manipulation in vitro des structures mésodermiques et métanéphriques permettaient, dans certaines conditions, d’obtenir un tissu doté de caractéristiques morphologiques et fonctionnelles proches de celles d’un néphron. Étant donné que chaque bourgeon du canal de Wolff préservait sa capacité d’induction réciproque, plusieurs ébauches néphroniques pourraient être obtenues à partir d’une quantité restreinte de matériel embryonnaire. La limitation principale de cette approche réside néanmoins dans la nécessité d’isoler les structures rénales primitives riches en cellules souches pluripotentes à partir d’un embryon. Reproduire l’organogenèse rénale in vitro, à partir de cellules souches embryonnaires, amniotiques ou adultes permettrait de contourner cette limitation technique et éthique. En outre, la modification génétique de ces cellules, notamment par transfection, pourrait améliorer leur immunocompatibilité voire leur fonctionnalité.
En l’état actuel de nos connaissances 8,9,10, quatre procédés clef doivent être maîtrisés pour parvenir à la régénération rénale : soit reprogrammer des cellules rénales endogènes, soit faire migrer des cellules dérivées de la moelle osseuse et des macrophages dans le rein, permettre la différenciation des progéniteurs rénaux, et en assurer une néo-angiogénèse contrôlée. Le processus de régénération semble similaire au développement rénal au travers de la dédifférenciation cellulaire, phénomène régulé par différents gènes (identifiés ou à découvrir). Les modèles d’ischémie/reperfusion rénale ont permis de bien comprendre ces différentes étapes.
A ce jour, les technologies les plus avancées sont l’utilisation de thérapies à base de cellules souches multipotentes, l’objectif principal étant d’obtenir soit l’induction d’une réparation cellulaire de l’organe endommagé en utilisant des cellules autologues ou héterologues soit de reprogrammer l’organe pour ré-initier son développement.
Ces cellules souches peuvent provenir de multiples sources : moelle osseuse (BMDC), cellules souches mésenchymateuses autologues dérivées du tissu adipeux (ADMSC), cellules souches embryonnaires (ES), cellules souches pluripotentes (iPS) ou des cellules de progéniteurs rénaux.
Doivent ensuite être parfaitement maitrisées les voies de signalisation de ces différenciations cellulaires et d’interaction des cellules entr’elles au risque d’aboutir dans le cas contraire à une apoptose précoce ou à l’inverse une prolifération tumorale. De nombreuses études sont en cours sur ces voies de signalisation (voie de PI3K/AKT/mTOR, voie de MAPK/ERK, voie de JAK/STAT, voie de Wnt-GSK3-béta-caténin, etc).
Enfin, le contrôle de l’angiogénèse (restauration et extension de la microarchitecture vasculaire) reste une étape clef permettant le maintien de la pérennité de l’édifice construit. Elle aussi est sous dépendance de facteurs à contrôler (VEGF par exemple).
Si quelques expérimentations humaines ont été menées, ces techniques restent encore à l’état de recherche. Certains pays (Taïwan) s’autorisent toutefois à des expérimentations très lucratives (Taiwan) dont il est encore difficile d’en évaluer l’efficacité à terme11…
Des projets européens sont en cours dont on espère qu’ils concurrenceront les projets étrangers (projet STELLAR) 12.
Toutes ces innovations ouvrent des voies d’espoir pour nos patients durement touchés par ces maladies rénales. Espérons qu’elles prennent rapidement forme pour eux.
« Si l’on peut en finir du passé avec l’oubli, on n’en finit pas de l’avenir avec l’imprévoyance » (Félicité Robert de Lamennais, 1854, Les pensées diverses)
Version pdf de la présentation téléchargeable ici :

1. Kooman et al. Creating a wearable artificia kidney : where are we now ? Expert Review of Medical Devices, 2015
2. Davenport et al. A wearable haemodialysis device for patients with end stage renal failure : a pilot study, Lancet, 2007
3.
https://nephronplus.wordpress.com4. Fissell et al. Achieving more frequent and longer dialysis for the majority : wearable dialysis and implantable artificial kidney devices, Kidney International, 2012
5.
https://pharm.ucsf.edu/kidney6. Jouret et al. Ingénierie tissulaire du parenchyme rénal : une hypothèse thérapeutique ? Med Sci, 2008
7. Rosines E et al. Staged in vitro reconstitution and implantation of engineered rat kidney tissue. Proc Natl Acad Sci USA 2007
8. Mae et al. Monitoring and robust induction of nephrogenic intermediate mesoderm from human pluripotent stem cells, Nature, 2012
9. Yamanaka et al. Current bioengineering methods for whole kidney Regeneration, Stem Cell International, 2015
10. Chou et al. Stem cells and kidney regeneration, Journal of the Formosan Medical Association, 2014
11.
https://stemcellthailand.org/therapies/renal-failure-kidney-disease12.
http://www.stellarproject.eu/