Les morphiniques
Docteur Jean-Pierre
CORBINAU
Maison
Médicale Jean XXIII
3
place Erasme de Rotterdam
59160
LILLE
Tél :
03 20 88 81 55
Mél :
jpcorbinau@maisonjean23.fr
De la douleur aux antalgiques
Formathon 2018
On
parle volontiers de douleur pour les douleurs physiques et de souffrance pour
les douleurs morales, mais au bout du compte, la douleur est toujours physique
(soma) et la douleur est toujours morale (psyché).
I.
La douleur
Les
douleurs peuvent être aiguës ou chroniques ou évoluer dans un contexte
carcinologique (douleur cancéreuse).
-
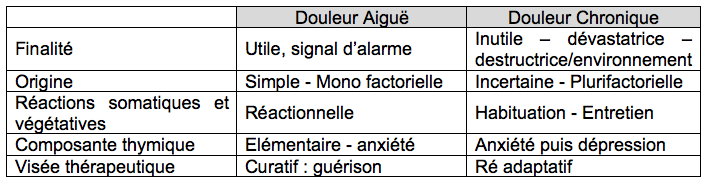
La douleur aiguë est un symptôme, un signal d’alarme.
-
La douleur chronique est un syndrome
multidimensionnel. La douleur est chronique, quelle que soit sa topographie
et son intensité, quand :
o
Elle est persistante ou récurrente, au-delà de
ce qui est habituel pour la cause initiale présumée, notamment si la douleur
évolue depuis plus de 3 mois avec réponse insuffisante au traitement
o
Et/ou s’il existe des détériorations
significatives et progressives des capacités fonctionnelles et relationnelles
du patient dans ses activités de vie quotidienne (familiale, sociale,
professionnelle…)
Lorsqu’elle
devient chronique, la douleur perd sa « finalité » de signal d’alarme
et devient une maladie en
tant que telle qu’elle que soit son origine.
La
douleur chronique doit être appréhendée selon un modèle bio-psycho-social, sa prise en charge reposant d’abord sur
une démarche évaluative puis sur un traitement, souvent multimodal, dont
l’objectif est ré adaptatif.
Les
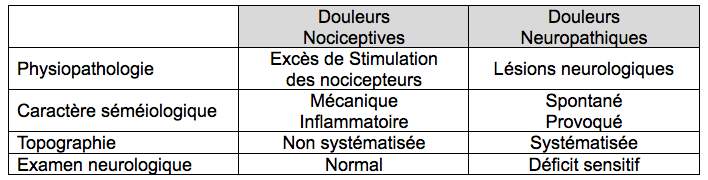
douleurs peuvent être de type différent, nociceptif
ou neuropathique, souvent
mixte. On parle également de douleur dysfonctionnelle, liée à un dysfonctionnement
des systèmes de contrôle de la douleur sans lésion identifiée. Récemment,
l’IASP[1]
a proposé de renommer ces douleurs dysfonctionnelles en douleurs nociplastiques[2].
On
distingue donc trois types de douleur chronique en fonction des mécanismes à
l’origine de la douleur :
1.
La douleur par
excès de nociception (ou inflammatoire)
La
douleur nociceptive ou par excès de nociception ou encore inflammatoire est une
douleur due à une
stimulation persistante et excessive des récepteurs périphériques de la douleur
: les nocicepteurs. Le système nerveux ne présente pas de lésion.
Ce
type de douleur peut survenir dans un contexte de cancer mais également dans
des contextes plus « bénins » comme la maladie arthrosique.
La
douleur nociceptive répond aux antalgiques, cette approche pharmacologique
devant être intégrée à une approche thérapeutique plus globale commune à toute
douleur chronique.
2.
La douleur neuropathique
L’IASP
définit la douleur neuropathique comme une douleur liée à une lésion ou une maladie affectant le
système somatosensoriel.
L’atteinte
du système somatosensoriel peut survenir dans un contexte neurologique évident,
la douleur survenant après une atteinte lésionnelle nerveuse :
- Zona,
- Neuropathie diabétique douloureuse,
- Douleur centrale survenant après un
accident vasculaire cérébral, une SEP…
Elle
peut survenir dans un contexte non neurologique comme en post-opératoire, la
chirurgie, même bénigne, est souvent responsable de lésions nerveuses.
La
douleur neuropathique se caractérise par des douleurs à type de brûlures ou de
décharges électriques avec à l’examen clinique une hypoesthésie ou, au
contraire, une allodynie. Elle est
souvent associée à des signes sensitifs non douloureux (paresthésies,
engourdissement, prurit). Son dépistage est facilité par l’utilisation de
questionnaires tels que le DN4[3]
qui repose sur l’identification des caractéristiques sémiologiques. (Douleur
neuropathique probable avec un score ≥ à 4 sur 10)

Le
dépistage de la douleur neuropathique est d’autant plus important qu’elle peut coexister
avec une douleur nociceptive dans le cadre d’une douleur mixte. C’est notamment
le cas lors de lombo-radiculalgies constituées d’une lombalgie le plus souvent
de mécanisme nociceptif et d’une radiculalgie de mécanisme neuropathique.
Sur
le plan pharmacologique, la douleur neuropathique répond mal aux antalgiques usuels
et nécessite la prescription, en première intention, de certains antiépileptiques
et/ou de certains anti-dépresseurs.
3.
La douleur dysfonctionnelle ou douleur
nociplastique
Les
douleurs sont dues à un dysfonctionnement des systèmes de contrôle sans
lésion identifiée. Les plus fréquentes sont :
- la céphalée de tension,
- la colopathie « fonctionnelle »
- la cystite interstitielle,
- la fibromyalgie.
En
l’état de nos connaissances, la douleur dysfonctionnelle répond peu au
traitement pharmacologique et sa prise en charge thérapeutique fait plus appel
à des approches non-pharmacologiques
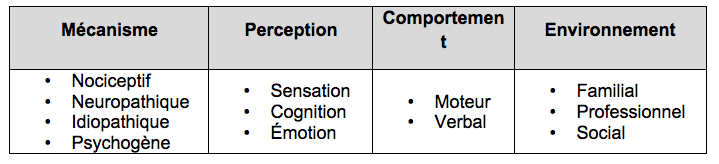
Modèle
multidimensionnel de la douleur à approche
bio-psycho-sociale
Ces
notions sont importantes à connaître car elles sont indispensables pour bien évaluer
la douleur, et donc pour bien la traiter.
II.
Evaluation de la douleur
Il
s’agit d’une étape importante et indispensable.
Évaluation
globale de toutes les composantes en une seule mesure évaluation
unidimensionnelle
- Rapide
-
Simple à score avec les Échelles
EVA – EN – EVS
o
EVA :
échelle visuelle analogique
o
EN :
échelle numérique
o
EVC :
échelle verbale simple
- Adaptée aux douleurs
aiguës
Évaluation
distincte des composantes sensitive, affective et émotionnelle, cognitive,
comportementale : évaluation multidimensionnelle
- Longue
-
Complexe
àscore
avec les Questionnaires MPQ et QDSA et Echelles comportementales ECPA – DOLOPLUS – SANSALVADOUR
- Adaptée aux
douleurs chroniques
III.
Les antalgiques :
On
parle moins aujourd’hui de la classification des antalgiques créée par l’OMS en
1986 et révisée en 1996, selon le schéma des 3 paliers qui avait pour principal objectif d’inciter les prescriptions
d’opioïdes et d’améliorer la prise en charge de la douleur cancéreuse[4].
La notion d’opioïde faible (palier 2) et celle d’opioïdes forts (palier 3)
incitaient à respecter des règles de prescription graduée. On ne passait au
palier suivant qu’en cas d’échec. On se privait de prescrire d’emblée des
opioïdes forts devant une douleur sévère.
Aujourd’hui,
on privilégie plutôt la classification[5]
de Pierre Beaulieu et David Lussier[6]
selon le mode d’action des antalgiques[7].
Cette classification
fait référence au mécanisme sous-jacent de la douleur, permettant d’intégrer
des médicaments nouveaux qui n’avaient pas leur place dans la classification de
l’OMS.
Cette nouvelle
classification s’adapte à tout type de douleur, chronique ou aiguë, cancéreuse
ou non cancéreuse et permet d’apporter une réponse thérapeutique aux
différentes étiologies de la douleur et ne plus rester cantonné aux douleurs
purement nociceptives.
« Les principales
caractéristiques[8]
sont :
-
elle
intègre tous les médicaments, y compris ceux initialement développés dans
d’autres indications notamment neuropathique
-
elle
évite la corrélation aléatoire entre intensité douloureuse et classe
d’antalgique
-
les
médicaments sont classés en fonction de leur mécanisme d’action
-
elle
permet d’optimiser la prise en charge thérapeutique après analyse du mécanisme
de chaque douleur
-
c’est
une classification évolutive permettant d’intégrer de nouvelles molécules »
Des publications
récentes et/ou recommandations de Sociétés Savantes comme la Revue Prescrire[9] – concernant notamment les
bénéfices-risques des opioïdes faibles et forts – incitent fortement à
reconsidérer la « vieille » stratégie de l’OMS et les conduites de
prescriptions qui en découlent.
Quand un opioïde est justifié
pour soulager une douleur nociceptive chez un adulte, la morphine à dose
minimale efficace a une efficacité plus constante que celle de la codéine.[10]
Ces avis, publications
et recommandations orientent les cliniciens à préférer une faible dose d’opioïde
fort plutôt qu’une
dose normale ou élevée d’opioïde
faible.
Messages à retenir8 :
-
La classification en 3
paliers de l’OMS devait être spécifique du cancer. En pratique, elle a été
utilisée pour tout type de douleurs. On préfère utiliser les termes d’opioïdes
« faibles » ou « forts » plutôt que palier 2 ou 3…
-
Si les opioïdes faibles
ont leur place dans la prise en charge de la douleur, les recommandations et
études comparatives les plus récentes indiquent qu’en cas de douleur cancéreuse
modérée, l’utilisation de morphine à faible posologie est préférable à celle du
tramadol ou de la codéine.
-
Malgré leur réputation
d’être « plus sûrs », les opioïdes faibles ne sont pas mieux tolérés que la
morphine à faible posologie. A efficacité antalgique équivalente, il n’est pas
démontré que leur risque addictif soit moins important.
-
Codéine, tramadol mais
aussi oxycodone sont métabolisés par les cytochromes, ce qui peut entrainer des
effets imprévisibles. Suite à des décès survenus chez des métaboliseurs rapides,
l’HAS a restreint début 2016 l’utilisation de la codéine chez l’enfant. Les
variations de métabolisme avec des effets imprévisibles concernent également
l’oxycodone et le tramadol.
-
L’efficacité des opioïdes
forts est comparable quelle que soit la molécule. En pratique, mieux vaut
privilégier la morphine, moins sujette aux variations de métabolisme et aux
interactions pharmacocinétiques. La morphine reste l’opioïde de référence
médico-économique.
-
La SFETD, dans ses
dernières recommandations[11],
précise : « Tous les opioïdes forts semblent similaires en termes d’efficacité
quelle que soit l’indication. A ce jour, il n’est pas recommandé d’utiliser un
opioïde fort plus qu’un autre (preuves modérées). Toutefois, le choix doit
prendre en considération, la facilité de titration, le coût, les effets
indésirables présentés par le patient, les données actuelles de la science, les
AMM, le remboursement du traitement. (Accord fort) »
IV.
Pour traiter une douleur, il faut donc
respecter quelques règles de base :
-
Déterminer
le mécanisme de la douleur
-
Adapter
le traitement en conséquence
-
Associer
les molécules
-
Initier
le traitement avec des petites doses : « Start slow and go
slow » surtout avec les patients fragiles
-
Débuter
par des formes à libération normale (forme dite LI, le « I » pour
immédiate, par abus de langage) et passer ensuite aux formes à libération
modifiée (forme dite LP, le « P » pour prolongée)
-
Penser
aux moyens non médicamenteux, traitements complémentaires souvent contributifs
V.
Traitements
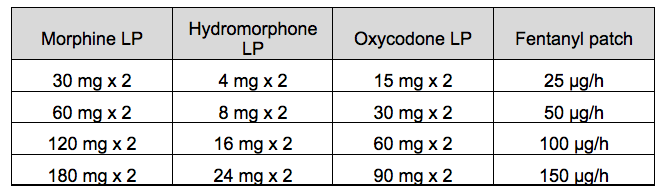
1. Equiantalgie des opioïdes
forts
-
Doses « équianalgésiques » de secours
-
Table pratique d'équiantalgie[12] des opioïdes forts dans
la douleur cancéreuse par excès de nociception
2.
Ne pas
confondre surdosage et effets secondaires qu’il faut savoir prendre en
compte
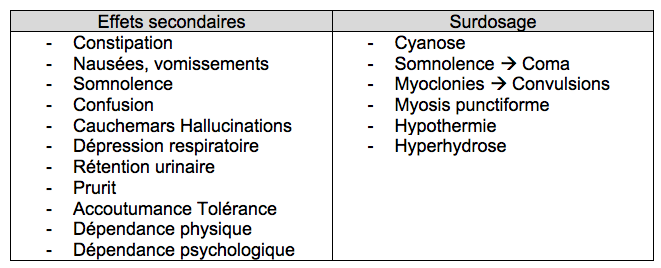
3.
Traitement des
douleurs neuropathiques
-
Anticonvulsivants :
Douleurs brèves, profondes et fulgurantes
o
Gabapentine : NEURONTIN® 2400 à 3600 mg /
24 h en 3 prises
o
Prégabaline : LYRICA® 150 à 600 mg / 24 h
en 2 ou 3 prises
o
Carbamazépine : TEGRETOL® en forme non LP
pour les névralgies
o
Clonazepam : RIVOTRIL® mais effet sédatif
et troubles neurologiques – retiré du marché
-
Antidépresseurs imipraminiques :
Douleurs superficielles dysesthésiques
o
Amitryptiline : LAROXYL® à partir de 25 mg
o
Clomipramine : ANAFRANIL® à partir de 25
mg
o
Duloxétine : CYMBALTA ®
-
Tramadol : alternative possible dans les 2
cas ?
-
Kétamine : activité anti NMDA
-
Traitements topiques :
o
Lidocaïne :
§
VERSATIS 5%® emplâtre médicamenteux (douleur
post-zostériennes)
§
EMLA 5 %
patch et crème à avant soins
(douleur aiguë)
o
Capsaïcine :
§
QUTENZA ® patch cutané (Douleur périphérique –
patient non diabétique)
-
Techniques de neuromodulation :
o
NSTC : à différencier de
l’électrothérapie +++
o
Stimulation cordonale postérieure médullaire
o
Stimulation corticale
o
Stimulation du ganglion spinal
o
Stimulation nerveuse périphérique
4. Classification de l’IASP Lussier
Beaulieu[13]
- Antalgiques
anti-nociceptifs
o
Non opioïdes
§ AINS
§ Paracétamol
o
Opioïdes
§ Codéine
§ Morphine
§ Oxycodone
§ Hydromorphone
o
Cannabinoïdes
- Anti-hyperalgésiques (pour
les douleurs centrales)
o
Antagonistes NMDA (Kétamine)
o
Antiépileptiques :
§ Gabapentine
Neurontin®, Prégabaline Lyrica®, Lamotrigine Lamictal®
o
Nefopam Acupan®
- Modulateurs
des contrôles descendants inhibiteurs (douleurs neuropathiques)
o
Antidépresseurs tricycliques :
Clomipramine Anafranil®, Amitriptyline Laroxyl®
o
Inhibiteurs de la recapture de la sérotonine et
de la noradrénaline
§ Venlafaxine
Effexor® Duloxétine Cymbalta®
- Modulateurs
de la transmission et de la sensibilisation périphérique
(douleurs neuropathiques périphériques)
o
Anesthésiques locaux
o
Carbamazépine Tégretol®,
o
Oxcarbazépine Trileptal®,
o
Topiramate Epitomax®
o
Capsaïcine
- Mixtes :
analgésiques anti-nociceptifs et modulateurs des contrôles descendants
inhibiteurs
o
Tramadol
o
Tapentadol
5.
Douleurs
intercurrentes et accès douloureux paroxystiques
-
Douleurs intercurrentes ou récurrentes à Ne pas confondre avec la période de
titration
o
Douleurs survenant n’importe quand ou à chaque soin
spécifique
o
Traitement :
§
Dose de secours = inter dose (souvent le 1/6ème
de la dose de 24 h)
§
Dose avant soin = protocole avant soin
-
ADP – Accès Douloureux Paroxystiques
o
Définition : exacerbation transitoire
spontanée ou déclenchée chez un patient douloureux chronique traité par un
traitement de fond équilibré depuis au moins 7 jours
o
Caractéristiques :
§
Début au paroxysme = 3 mn (médiane)
§
Durée = 30 minutes (1 à 240 mn)
§
Nombre : 1 à 14 par 24 h. Moyenne 4 à 7
§
Intensité modérée à intense : 5 à 10 / 10
o
Différent d’une douleur de fin de dose. Morphine
LP pas toujours efficace sur 12 h
o
Mécanisme divers : nociceptif –
neuropathique – mixte
o
Traitement des ADP
§
Nociceptif = Fentanyl transmuqueux (Forte biodisponibilité
et Liposolubilité)
§
Neuropathique = pas grand-chose….
6. Douleurs, insuffisance rénale
chronique et Opioïdes :
Lesquels choisir ?
Comment adapter le traitement ? [14]
Sont
rapportées textuellement ci-dessous, les conclusions pratiques de cet article :
« Lorsqu’un traitement antalgique
doit être mis en place chez un patient atteint d’IRC, l’évaluation du niveau
d’insuffisance rénale et la connaissance des propriétés pharmacologiques des
différents opioïdes apparaissent comme des préalables indispensables pour un
choix éclairé de molécule.
La littérature abonde de classifications
basées sur leur niveau de risque relatif[15]
[16]
[17] :
-
Fentanyl,
méthadone et buprénorphine apparaissent comme les molécules les plus sûres :
elles forment des métabolites principalement inactifs (ou supposés comme tels),
ne laissant pas craindre, a priori, d’effet indésirable causé par leur
accumulation dans l’organisme ;
-
Morphine,
oxycodone, tramadol et hydromorphone peuvent être utilisés mais avec
précautions : Des effets indésirables majorés ont été rapportés lors de
leur utilisation chez des patients atteints d’IRC, avec des adaptations
posologiques menées en conséquence ;
-
La
codéine enfin, en raison de ses effets indésirables majorés, associés à un
métabolisme imprévisible semble à éviter. »
Le
tableau ci-dessous, tiré de la Revue Médicale Suisse[18],
propose des schémas d’adaptation de la posologie selon l’opioïde envisagé et le
niveau d’IRC.
Tableau :
Adaptation posologique des différents analgésiques couramment utilisés en
fonction de l’insuffisance rénale (modifié selon Aronoff et al.[19])
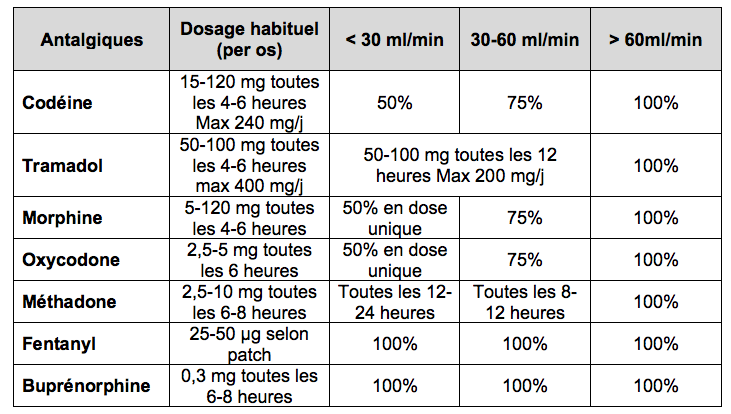
Retenir qu’en cas
d’insuffisance rénale, la règle du « start low, go slow » doit être
appliquée
7. Quelques notions de
pharmaco-épidémiologie des antalgiques opioïdes[20]
Pendant
la période 2001 – 2013, la délivrance des opioïdes a été multipliée par 2 dans
le monde et par 4 aux USA
Il
s’agit d’un phénomène mondial avec forte augmentation de l’usage et des
prescriptions d’opioïdes.
-
Période 2004 – 2008 : + 13 % en France
-
Période 2000 – 2010 : + 466 % au Royaume
Uni
-
Période 2004 – 2015 : Oxycodone +
1 550 %
On
reconnait un mésusage de 20 à 25 % chez le patient douloureux chronique
Notion
de « Docteur shopping » :
quand il y a 2 médecins prescripteurs et 3 pharmaciens avec des
ordonnances qui se chevauchent. Dans ces situations, le risque de décès est
multiplié par 3 chez les patients qui sont dans cette situation de
« docteur shopping ».
Toujours
se méfier de l’association Opioïdes - Benzodiazépines
Prévalence des overdoses aux opioïdes en France
-
Ampleur plus limitée mais progression du signal
proche de celle des USA
-
Probable part imputable aux antalgiques
opioïdes compte tenu des profils des patients identifiés
-
Mieux identifier la / les populations à risque
voire les molécules concernées :
è
Analyser ce phénomène sur d’autres bases de
données comme la Base Nationale de PharmacoVigilance BNPV ou les Systèmes
d’Information des Centres Anti Poison SiCAP, …
Actions possibles pour limiter ce risque :
-
Mieux informer les patients sur les risques
-
Eduquer les patients au bon usage des
médicaments opioïdes
-
Information répétée sur une automédication
responsable
-
Dépister les facteurs de risque de mésusage.
-
Favoriser l’interdisciplinarité dans les prises
en charge (double et triple diagnostic)
-
Elargir la prescription de naloxone aux
patients douloureux traités par un antalgique opioïde
-
Maintenir une prise en charge adéquat de la
douleur (aiguë et chronique) et un accès aux antalgiques opioïdes
Messages :
-
+ 74 % des français exposés aux antalgiques
opioïdes forts
-
+ 1 550 % de français traités par
Oxycodone
-
+ 128 % d’hospitalisations pour overdoses
opioïdes depuis 2000
-
40 % des hospitalisations pour overdoses
opioïdes hors dépendance, hors cancer, hors chirurgie récente
8.
Quelques définitions :
Allodynie =
douleur causée par un stimulus qui normalement ne produit pas de douleur
Analgésie =
absence de douleur en réponse à une stimulation qui serait normalement
douloureuse
Anesthésie = absence de toute sensation à une stimulation, douloureuse ou non
Anesthésie douloureuse =
douleur ressentie dans une région privée d’autres sensations somesthésiques
Dysesthésie =
sensation anormale et désagréable
Hyperalgésie =
réponse exagérée à une stimulation normalement douloureuse
Hyperesthésie =
sensation disproportionnée à une stimulation sensitive
Hyperpathie =
syndrome douloureux caractérisé par une réponse disproportionnée, secondaire à
une stimulation cutanée. Cette réponse persiste après la stimulation et peut
étendre à un hémicorps. Elle persiste après l’arrêt de la stimulation.
Hypoalgésie =
diminution de la réponse à une stimulation douloureuse
Hypoesthésie =
réaction diminuée à toute stimulation de la peau, douloureuse ou non
Paresthésie =
sensation anormale qui peut être spontanée ou provoquée
9. Pour conclure…
et reprendre les propos du Pr François CHAST[21] de l’Académie nationale
de pharmacie, sur l’histoire des médicaments et notamment les antalgiques, les
opiacés ont une histoire mais une histoire inachevée, toujours en cours de
développement. Il s’agit d’une histoire ancienne et enthousiasmante, qui a occasionné
des avancées médicales, mais qui est controversée aujourd’hui. On y retrouve un
aspect de gloire mais aussi un aspect d’indignité.
C’est une
histoire universelle, la douleur se rencontre dans toutes les spécialités qui
nécessitent l’utilisation d’antalgiques, c’est une histoire complexe
scientifiquement. C’est une histoire culturellement, religieusement,
socialement particulière.
Il y a des frontières imprécises car elles traduisent
une limite entre le somatique et le psychique.
Le passé est probablement trop riche en certitudes,
insuffisamment étayées en démonstrations ; l’avenir devrait montrer
introspection et modestie…
10. Relais entre opioïdes[22]
Afin
d’assurer une couverture antalgique de qualité, les relais entre morphiniques
tiennent compte des durées et des délais d’action de chaque médicament.
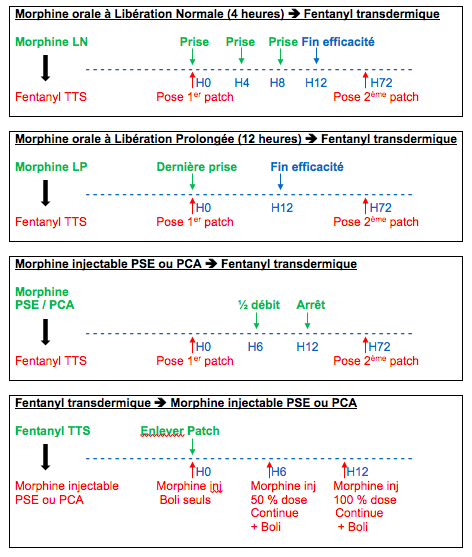
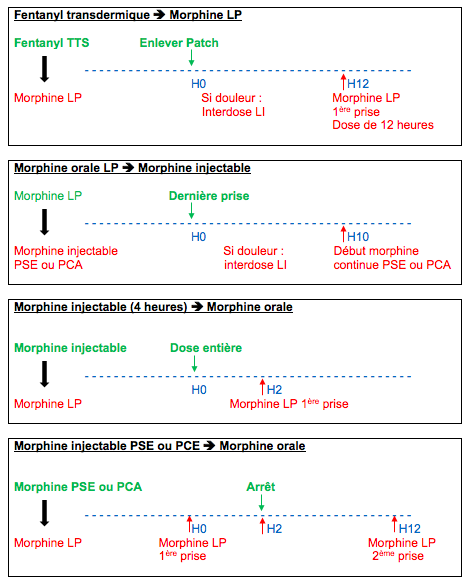
11. Table d’équiantalgie
des opioïdes TEO[23]
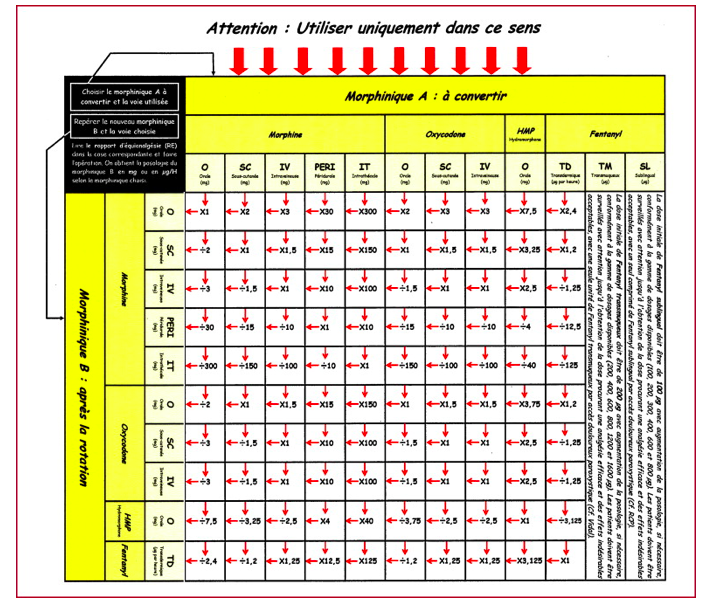
Quelques autres références
12. http://www.sfetd-douleur.org/sites/default/files/u161/evaluation/dn4ok.pdf
13. http://www.em-consulte.com/article/245049/table-dequiantalgie-des-opioides-teo-un-outil-simp
14.
Module 3 de formation Change
Pain
15. BOUHASSIRA
D, LANTERI-MINET M, ATTAL N.
16. HAS.
Douleur Chronique. Synthèse avril 2009
17. LANTERI-MINET
M, Preuves et Pratiques – septembre 2012
18. BLOND
Serge, Formathon 09 mars 2008 – 21 mars 2009 et 16 mars 2013
19. Livre
blanc de la douleur 2017. Etat des lieux et propositions pour un système de
santé éthique, moderne et citoyen. SFETD
http://www.sfetd
douleur.org/sites/default/files/u3349/Agenda/2017/livre_blanc.pdf
[1] International Association for
the Study of Pain. www.iasp-pain.org/index.aspx
[2] PAIN. 157(7) :1382–1386, JUL 2016. Do
we need a third mechanistic descriptor for chronic pain states ?
Eva
Kosek ; Milton Cohen ; Ralf Baron ; Gerald F. Gebhart ; Juan-Antonio Mico ;
Andrew S.C. Rice ; Winfried Rief ; A. Kathleen Sluka
[3] Le questionnaire DN4 : le nouvel outil
d’aide au diagnostic des douleurs neuropathiques. Didier Bouhassira
Douleurs Vol 6, N° 5 - octobre 2005 pp. 297-300
Doi : DOU-10-2005-6-5-1624-5687-101019-200506167
[5] IASP Press, Pharmacology of Pain,
2010
[7] Les
paliers de l’OMS : au placard !!! Doi :
10.1016/j.douler.2014.02.010. P. 41-43
Philippe Bertin. Service de
rhumatologie, centre de la douleur, CHU de Limoges, 2, avenue
Martin-Luther-King, 87000 Limoges, France
[9] Prescrire.
Les opioïdes faibles pas plus sûrs que la morphine à faible dose http://www.prescrire.org/fr/3/31/51416/0/NewsDetails.aspx
[10] Prescrire. Mars 2017. Tome 37 n° 401.
Pages 199-203
[11]
Utilisation
des opioïdes forts dans la douleur chronique non cancéreuse chez l’adulte : Recommandations
de bonne pratique clinique par consensus formalisé, janvier 2016.
[12]Fédération
des activités de soins palliatifs et de soins de support du CHU de Grenoble -
Alpes – Octobre 2016
http://www.sfap.org/system/files/table_pratique_dequiantalgie_octobre_2016.pdf
[14] http://www.rvh-synergie.org/images/stories/pdf/Opioides_et_insuffisance_renale.pdf Dr Stéphane ROBINET, Strasbourg (67),
Dr Éric SALVAT, Strasbourg (67), Dr Virginie PIANO, Draguignan (83), Dr Jacques
POUYMAYOU, Toulouse (81), Pr Alain SERRIE, Paris (75)
[15] King S, Forbes
K, Hanks GW, Ferro CJ, Chambers EJ. A systematic review of the use of opioid
medication for those with moderate to severe cancer pain and renal impairment :
A European Palliative Care Research Collaborative opioid guidelines project. Palliative Medicine 25(5) 525–552.
[16] Bourquin V. Petignat PA et al.
Analgésie et insuffisance rénale. Rev Med Suisse 2008 ; volume 4.
2218-2223.
[17] Johnson S.
Opioid safety in patients with renal or hepatic dysfunction. Pain Treatments topics. June 2007.
[18] Bourquin V. Petignat PA et al.
Analgésie et insuffisance rénale. Rev Med Suisse 2008 ; volume 4. 2218-2223.
[19] Aronoff GR,
Benett WM, Berns JS, Brier ME, Kasbekar N. Drug prescribing in renal failure. American College of Physician, 2007.
[20] Nicolas AUTHIER (Clermont-Ferrand)
Directeur de l’Observatoire français des médicaments antalgiques. SFETD 17 -
Nice 2017
[21] 4èmes
carrefours de la douleur – Paris – 26 janvier 2018
[22] Dr
Jean-Pierre CORBINAU – CLUD – Jean XXIII - 2018
[23] Opioids equinalgesic table : A simple, practice and original tool. Doi
: 10.1016/j.douler.2009.12.002
Table
d’équiantalgie des opioïdes (TEO) : un outil simple, pratique et
original. Jean-Michel Pellat a, Nicolas Béziaud b, Erik Vassort a, Guillemette Laval b
a Unité d’évaluation et de traitement de
la douleur, groupe hospitalier mutualiste des Eaux Claires, 3 bis, rue du
Dr-Hermitte, 38000 Grenoble, France
b Centre de
soins palliatifs et de coordination en soins de support, pôle
oncologie-hématologie, CHU de Grenoble, BP 217, 38043 Grenoble cedex 9,
France