Prise en charge clinique des troubles de l’odorat.
Dr Geoffrey Mortuaire
Service ORL CHU Lille (Formathon 2018)
L’analyse d’un trouble chronique de l’olfaction (dysosmie) nécessite :
- La caractérisation précise du type de dysosmie,
- La connaissance des cadres étiologiques les plus fréquemment observés,
- Un interrogatoire et un examen clinique ciblés permettant de rapidement cerner ces étiologies,
- Le choix raisonné d’éventuels examens complémentaires.
INTRODUCTION – MÉCANISMES DE L’OLFACTION
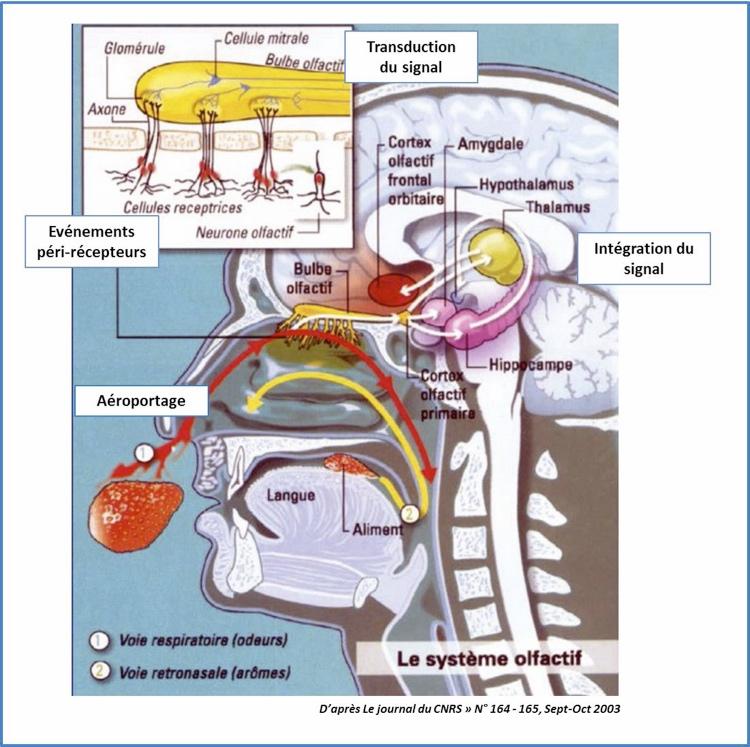
Les événements conduisant à la perception d’une odeur peuvent être schémati quement analysés en 4 étapes (Bonfils P. 2004):
1. L’aéroportage.Il s’agit d’une étape aérodynamique. Les molécules odorantes sont entraînées par le flux respiratoire nasal pour atteindre la partie haute de la fente olfactive de part et d’autre de la cloison nasale et entrent en contact avec le neuroépithélium. La stimulation du neuroépithélium peut se faire par voie directe (orthonasale) lors de l’inspiration nasale (perception des odeurs) Elle peut aussi se faire par voie rétrograde (rétronasale) lorsque les propriétés aromatiques des aliments présents en bouche (flaveurs) viennent entrer en contact avec le neuroépithélium via le nasopharynx derrière le voile du palais. C’est la rétro - olfaction qui participe à l’identification précise des arômes des aliments ingérés alors que la fonction gustative de la langue à proprement parler ne peut identifier que les saveurs salé, sucré, amer, acide et l’umami (Il existe une cinquième saveur, mise à jour au début du XXe siècle par un chercheur japonais : l' umami, prononcer "oumami". C‘est un mot valise, contraction de "umai" (délicieux) et "mi" (goût), se traduisant littéralement par "goût délicieux")
2. Les événements péri-récepteurs.Les molécules odorantes le plus souvent hydrophobes doivent pour accéder au neuroépithélium traverser le mucus hydrophile. Des protéines spécifiques impliquées dans le transport des molécules odorantes (« Odorant Binding Protein ») permettent le franchissement de ce mucus.
3. La transduction.Il s’agit de la transformation du message chimique en un message électrique. Les molécules odorantes se fixent sur les récepteurs des neurones olfactifs primaires. Ces derniers convergent vers différents glomérules présents au sein des bulbes olfactifs. Le codage de l’information olfactive résulte de l’activation différentielle des glomérules. L’information à ce niveau est relayée par les neurones olfactifs secondaires en direction des centres olfactifs.
4. L’intégration centrale.L’image sensorielle issue de la stimulation différentielle des glomérules au niveau des bulbes olfactifs est interprétée par le système limbique (cortex olfactif primaire, hippocampe, thalamus) et le néocortex orbito-frontal. Ce traitement participe à la discrimination des odeurs, à la mémoire olfactive et aux jugements hédoniques.
Figure 1 : Mécanismes de l’olfaction.
CARACTERISATION DU TYPE DE DYSOSMIE
On distingue les dysosmies quantitatives et qualitatives (Frasnelli J et al. 2004).
1. Les dysosmies quantitatives.Les dysosmies quantitatives correspondent à une augmentation de la perception olfactive (hyperosmie, rarement observée), à une diminution de la perception olfactive (hyposmie) ou à une abolition de toute perception olfactive (anosmie).
2. Les dysosmies qualitatives.Lorsque le patient se plaint de percevoir « une mauvaise odeur » dont on peut attribuer
l’origine à une stimulation odorante réelle ou non, on parle de cacosmie.
Lorsque l’odeur perçue par le patient est modifiée par rapport à sa référence mémorisée et n’est donc pas reconnue comme telle, on parle de troposmie (distorsions) ou de parosmie. Les parosmies consistent donc en des perceptions perverties souvent qualifiée de désagréable (odeur de brûlé, d’excréments), déclenchées par la présence d’une odeur réelle habituellement agréable.
Lorsque le patient perçoit une odeur en l’absence de toute stimulation olfactive, on parle de phantosmies et d’hallucinations olfactives.
De manière schématique, les dysosmies quantitatives peuvent concerner une atteinte de l’aéroportage, des événements péri-récepteurs ou de l’acheminement de l’information olfactive jusqu’aux centres d’intégration. Il s’agit de pathologies naso-sinusiennes inflammatoires, traumatiques, toxiques, métaboliques, de pathologies malformatives ou de pathologies tumorales. Les cacosmies sont le plus souvent d’origine infectieuse dento- sinusienne ou liée à un reflux gastro-oesophagien. Les parosmies concernent une altération de la transduction du signal ou de son intégration et sont notamment observées dans les dysosmies post-rhinitiques ou post-traumatiques. Les phantosmies concernent une altération de l’intégration du signal et sont observés dans les pathologies neurosensorielles (épilepsies, tumeurs cérébrales, neuro-dégénérescence, aura migraineuse) ou psychiatriques.
CADRES NOSOLOGIQUES DES DYSOSMIES
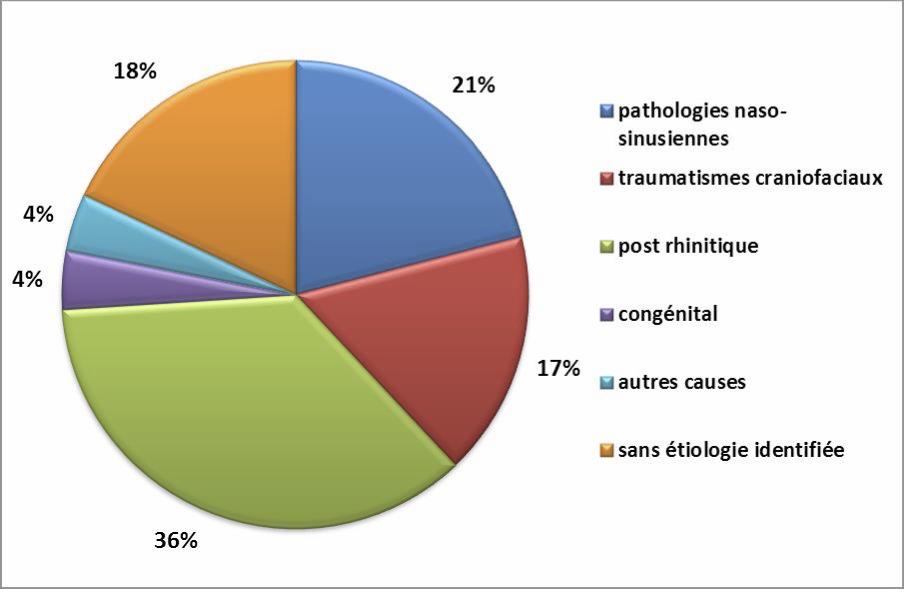
Figure 2 : Distribution des principales étiologies (d’après Landis B. http://www.hcuge.ch)
1. Les pathologies naso-sinusiennes.Les dysosmies quantitatives par trouble de l’aéroportage ou altération des événements péri-récepteurs sont particulièrement concernées par les étiol ogies naso-sinusiennes. L’association à d’autres symptômes spécifiques (obstruction nasale, rhinorrhées, éternuements, prurit nasal, épistaxis, douleurs sinusiennes) est évocatrice. L’examen endoscopique permet d’identifier des anomalies muqueuses (Bonfils P et al. 2001).
Les rhinosinusites chroniques avec ou sans polype entraînent un œdème muqueux et une hypersécrétion de mucus gênant la diffusion des particules odorantes. Dans la polypose naso-sinusienne, l’hyposmie est un symptôme observé jusque dans 90% des cas selon les séries analysées (Vandenhende-Szymanski C et al. 2015). Les rhinites chroniques (allergiques ou non allergiques) favorisent aussi un rétrécissement œdémateux de la fente olfactive et une modification des propriétés du mucus pouvant al térer l’accessibilité aux récepteurs olfactifs. Dans les rhinites chroniques, des hyposmies, souvent qualifiées de modérées, sont observées dans 20 à 40% des cas (Stuck BA et al. 2015). L’efficacité de la corticothérapie per
os pendant 5 jours à 1mg/kg/J sur l’amélioration des troubles olfactifs dans les rhinosinusites et les rhinites constitue un test diagnostique.
Les pathologies tumorales, par l’effet de masse ou par la destruction de l’épithélium olfactif et/ou de la région péri-bulbaire, sont aussi une cause potentielle de dysosmies. Une exposition professionnelle à la poussière de bois ou aux tanins en tant que facteur causal de la tumeur est à rechercher. Devant une dysosmie inexpliquée, ce diagnostic doit toujours être éliminé par une IRM centrée s ur les voies olfactives.
Les cacosmies sont caractéristiques des pathologies infectieuses dento-sinusiennes. Le diagnostic sera basé sur l’anamnèse avec la notion d’affections dentaires, l’unilatéralité des symptômes en projection du sinus maxillaire, la présence de rhinorrhées muco-purulentes et l’efficacité relative des antibiotiques sur l’amélioration du trouble olfactif.
2. La dysosmie post-rhinitique virale (postviral olfactory loss).Il s’agit de la première cause de dysosmie dans le monde (36%). Elle serait essentiellement liée à une atteinte de la transduction du signal par destruction des neurones olfactifs primaires. Le diagnostic est avant tout basé sur l’anamnèse. Le principal problème est d’établir avec certitude la relation exacte entre la rhinite aiguë et la persistance ou l’apparition de la dysosmie. Ce tableau clinique se traduit souvent par une hyposmie ou une anosmie. Des parosmies, attribuables potentiellement à une altération de la chimiotopie glomérulaire lors de la régénérescence tiss ulaire post-rhinitique, peuvent être observées. Ce type de dysosmie touche le souvent les femmes (65 à 70%) après l’âge de 50 ans. Il n’existe aucun traitement dont l’efficacité ait été démontrée (corticothérapie, supplémentations vitaminiques ou oligoéléments) (Harless L et al. 2016). La dysosmie résiduelle observée au- delà de 1 an serait définitive. Une étude menée en 2014 sur 63 patients atteints de dysosmie post-rhinitique virale retrouvait un taux de récupération de 31,7% avec un suivi moyen de 33 mois (Lee DY et al. 2014).
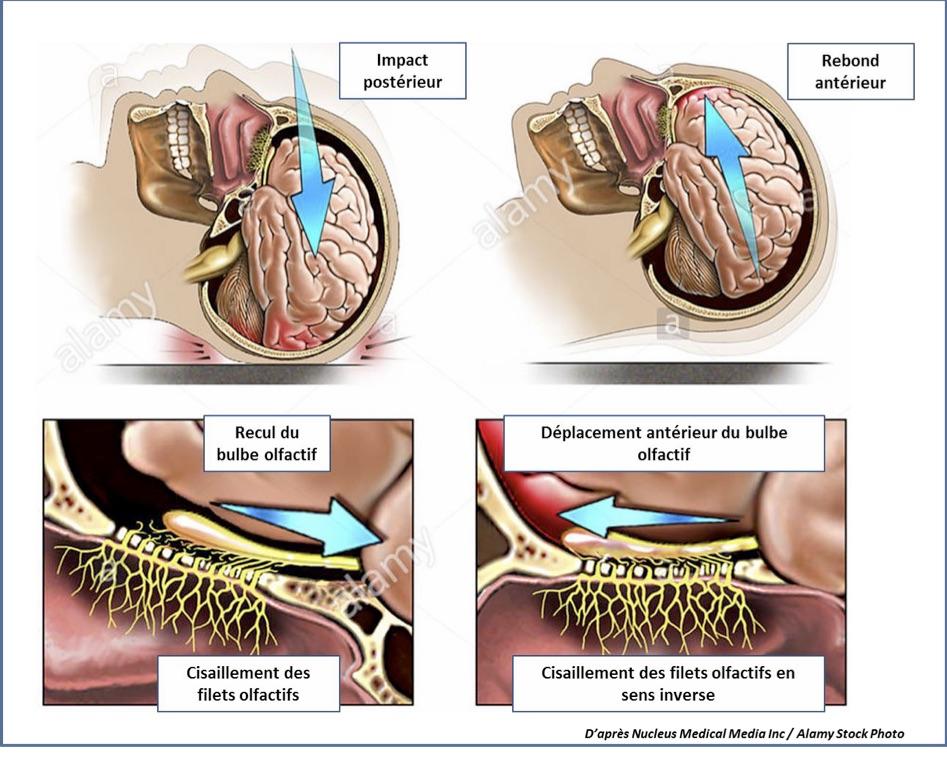
3. La dysosmie post-traumatique.Elle représente 17% des étiologies. Le diagnostic s’appuie aussi sur l’anamnèse et peut être retardé chez un patient dont le traumatisme s’est accompagné d’un séjour en réanimation avec sédation prolongée. On retrouve le plus souvent une anosmie et dans 40% des cas des parosmies. Elle s’explique par trois mécanismes qui peuvent être associés : un cisaillement des neurones olfactifs primaires au niveau de la lame criblée (figure 3), une plaie du neuroépithélium par fracture au contact de la fente olfactive et des lésions ischémiques/hémorragiques des centres olfactifs. L’évolution de la dysosmie pourrait être définitive après 3 mois d’évolution. Le taux de récupération a été estimé à 10% à 13 mois sur une série de 99 dysosmies post-traumatiques (Reden J et al. 2006).
Figure 3 : Mécanisme de la dysosmie post-traumatique par cisaillement.
4. Les dysosmies dites « idiopathiques ».Ce cadre nosologique regroupe tous les patients pour lesquels aucune étiol ogie n’a pu être clairement identifiée par l’interrogatoire, l’examen ORL et les explorations complémentaires accessibles actuellement. Il pourrait s’agir pour certains patients de dysosmies post-rhinitiques virales méconnues. L’hypothèse d’un vieillissement physiologique de l’organe olfactif (« presbyosmie ») est aussi une hypothèse à retenir. La prévalence de la dysosmie est estimée à 60% au-delà de 80 ans avec une altération des performances olfactives observées à partir de 60-65ans (Murphy C et al. 2002). Les altérations des performances olfactives liées au vieillissement comportent une augmentation des seuils olfactifs, une dégradation de la mémoire de reconnaissance ainsi qu’une diminution de l’intensité percue et des capacités de discrimination et d’i dentification (Bianchi AJ et al. 2015).
5. Les dysosmies congénitales. Ces étiologies sont rares (4%). La dysosmie est souvent de type quantitatif. Elle peut être syndromique :
- Le syndrome de Kallmann-de Morsier (hypogonadisme hypogonadotrope, stérilité, anosmie).
- Le syndrome de Bardet-Biedl (Laurence-Moon) (rétinite pigmentaire, polydactylie, hypogonadisme, retard mental).
- Le syndrome CHARGE (Coloboma, Heart defect, Atresia choanae, Retarded growth and development, Genital hypoplasia, Ear anomalies/deafness ).
- Le syndrome Johnson-Mc Millin (alopécie, surdité, hypogonadisme, agénésie dentaire).
La dysosmie peut aussi être isolée (Isolated Congenital Anosmia)( Sailani MR et al. 2017). Le diagnostic sera évoqué devant un trouble olfactif connu depuis l’enfance. L e symptôme peut être sous -estimé par le patient qui pourra compenser ce déficit par un vocabulaire trigéminal (« ça sent piquant ») ou gustatif (« ça sent sucré »). L’hypoplasie ou l’agénésie bulbaire sera diagnostiquée sur une IRM en coupes coronales.
6. Les autres étiologies.Elles sont rares et procèdent de différents mécanismes.
Les causes toxiques (métaux lourds) induiraient une altération des neurones olfactifs primaires. L’effet d’une exposition chronique dans un cadre professionnel a été étudié et a montré une altération des performances obtenues par tests psychopsychiques (Altman KW et al. 2011) (Antunes MB et al. 2007).
Les toxiques physiques se limitent à la radiothérapie. Le tabagisme chronique est aussi impliqué dans la dégradation de la foncti on olfactive (Glennon SG et al. 2017).
- Les causes médicamenteuses sont exceptionnelles. Cette étiologie sera évoquée devant l’évolution du symptôme en fonction de la poursuite ou de l’arrêt du traitement (Jafek BW et al. 2004).
- Des causes métaboliques sont décrites (insuffisance rénale, insuffisance hépatique, hypothyroïdie, diabète) (Norès JM et al. 2000) (Chan JYK et al. 2017). Dans un contexte évocateur, le bilan biologique permettra d’identifier le trouble métabolique sous-jacent.
- Les atteintes tumorales du système olfactif central sont dominées par le méningiome olfactif. Cette étiologie ne représente pourtant que 0,5% des étiologies de dysosmies.
- Les pathologies psychiatriques peuvent aussi être citées (phantosmies dans les psychoses, hyposmie avec anhédonie dans les syndromes dépressifs) (Kohli P et al. 2016.)
- Les maladies neurodégénératifs (Parkinson, Alzheimer, SEP) peuvent s’accompagner de troubles olfactifs avec une altération des seuils de détection et des capacités discriminatoires. La dys osmie surviendrait à un stade précoce, avant l’apparition des troubles cognitifs dans la maladie d’Alzheimer (MA) et son importance est directement liée à la gravité de la démence. Les troubles olfactifs concerneraient 85 à 90 % des patients atteints de MA. Ils pourraient ainsi représenter un facteur prédictif de la MA et jouer un rôle majeur dans son dépistage (Demarquay G et al. 2007). Des travaux ont ainsi montrés que les patients porteurs de l’allèle ?4 de l’Apo- lipoprotéine E (associé à la MA) sans troubles cognitifs mais avec une altération de la fonction olfactive ont des lésions de dégénérescence neurofibrillaire au niveau des centres olfactifs (hippocampe et cortex entorhinal) précurseurs de la MA (Wilson RS et al.2009).
CONDUITE A TENIR EN PRATIQUE
1. InterrogatoireCette revue des principales étiologies permet de souligner l’importance de l’anamnèse dans l’identification du type de dysosmie et de sa cause potentielle. La notion de traumatisme ou d’épisode infectieux viral (apparition rapide du trouble olfactif), l’association d’autres symptômes rhino-sinusiens (apparition progressive du trouble olfactif) permettent en pratique d’identifier 74% des étiologies (Figure 2). L’examen ORL nasofibros copique est indispensable en cas de signes fonctionnels rhino-sinusiens pour identifier un œdème muqueux, des polypes inflammatoires ou une masse tumorale. Une atteinte associée des paires crâniennes, la présence de céphalées voire de signes d’HTIC évoquent un processus expansif. Au-delà de 80 ans, bien que les troubles olfactifs soient fréquents, la même démarche diagnostique est indispensable pour étayer toutes les étiologies possibles.
2. Examens complémentaires de routineLe recours aux examens complémentaires est guidé par les éléments d’orientation clinique :
- La TDM naso-sinusienne sans injection en cas de suspicion de pathologies rhino- sinusiennes chroniques. Cet examen peut aussi être utile pour rechercher des stigmates de traumatisme de la base du crâne ou des foyers dentaires à l’origine d’une cacosmie.
- l’IRM naso-sinusienne en cas de suspicion de pathologie tumorale. Cet examen sera aussi utile devant un bilan étiologique négatif pour rechercher une atrophie ou une agénésie des bulbes olfactifs en cas de troubles olfactifs congénitaux ou pour rechercher un méningiome olfactif. Des études récentes ont montré que le volume des bulbes olfactifs pouvait être corrélé à l’importance des troubles olfactifs au cours des dysosmies post-rhinitiques virales et post-traumatiques (Rombaux P et al. 2006 a et 2006b). Des valeurs normatives ont été proposées. Pour des sujets sains entre 19 et 79 ans, le volume moyen des bulbes olfactifs est estimé à 70 mm3. Existe une forte
variabilité interindividuelle allant de 41 à 97 mm3 (Rombaux P et al. 2009).
- Le bilan rénal, le bilan hépatique, le bilan thyroïdien ou la glycémie ne sont pas demandés systématiquement mais uniquement en cas d’arguments pour ces pathologies bien que leur rôle étiologique dans la dysosmie ne puisse de toute façon pas être affirmé avec certitude.
Un avis neurologique pourra être utile chez un patient présentant dès 50 ans des troubles olfactifs inexpliqués même en l’absence de troubles cognitifs pour permettre le bilan précoce d’une éventuelle pathologie neuro-dégénérative.
3. Examens spécifiquesLes tests psychophysiques permettent de préciser la nature de la dysosmie (qualitative et/ou quantitative), de déterminer de seuils de détection, et d’analyser les capacités d’identification et de discrimination du patient. Il s’agit d’une évaluation subjective basé e sur des échantillons calibrés d’arômes. Le test doit être rapide et facile à utiliser pour qu’il puisse trouver sa place en pratique clinique. La qualité des résultats est dépendante de la collaboration du patient et de l’expérience de l’opérateur. Ces tests sont utiles pour le suivi lorsqu’une prise en charge thérapeutique peut être proposée. De nombreux kits sont commercialisés (Sniffin’Sticks® Test, University of Pennsylvania Smell Identific ation Test® (UPSIT), European Test of Olfactory Capabilities (ETOC)). Le coût n’est pas négligeable.
Les tests objectifs sont le plus souvent réservés à la recherche comme l’IRM fonctionnelle, la PET ou l’électro-olfactogramme.
Concernant les Potentiels Evoqués Olfactifs (PEO), ils font l’objet d’une application régulière en clinique dans des centres spécialisés. L’enregistrement des PEO se fait par électrodes EEG et nécessite la sommation de plusieurs stimulations olfactives identiques. Cette stimulation doit être maîtrisée en temps et en concentration et doit éviter toute stimulation trigéminée concomitante. Ces tests objectifs nécessitent une bonne préparation du patient et le temps d’acquisition des réponses est long.
TRAITEMENT
Il est guidé par l’étiologie lorsque celle-ci a pu être identifiée.
Le traitement des dysosmies quantitatives observées au cours des pathologies naso - sinusiennes repose sur la corticothérapie topique (pulvérisations/aérosols). La corticothérapie per os en cure courte proposée en test diagnostique peut être renouvelée 3 voire 4 fois par an. Les traitements corticoïdes per os continus et les corticoïdes retard type triamcinolone bien que ressentis comme très efficaces par le patient sont contre -indiqués en raison des risques pour le fonctionnement hypothalamo-hypophysaire. Dans la polypose naso-sinusienne, la chirurgie à type de polypectomie ou d’ethmoïdectomie peut être proposée en cas d’échec du traitement médical. Son efficacité s’exprime surtout sur le symptôme obstructif mais un bénéfice a aussi été observé sur les troubles olfactifs (Vandenhende-Szymanski C et al. 2015).
La cacosmie observée au cours des affections dento-sinusiennes est résolue par l’éradication du foyer infectieux dentaire et le drainage sinusien.
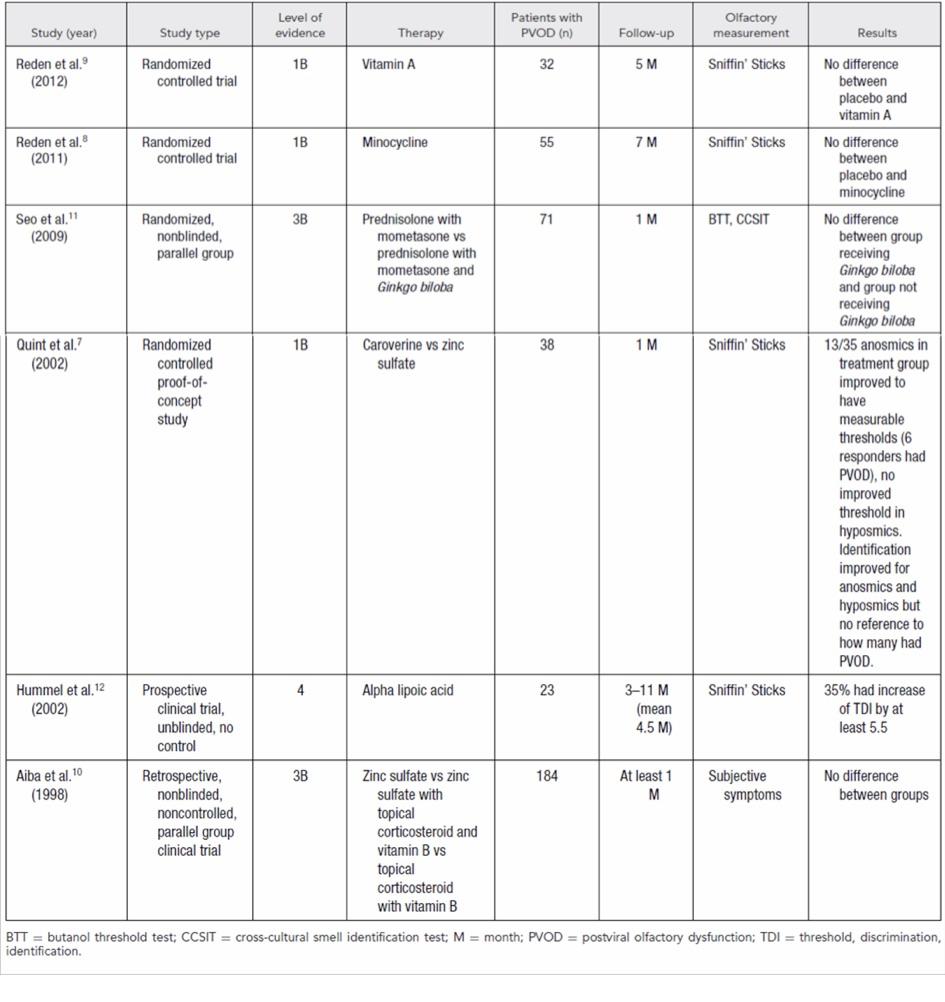
Les dysosmies post-rhinitiques virales et post-traumatiques ne bénéficient actuellement d’aucun traitement médical ou chirurgical d’efficacité démontrée (Harless L et al. 2016). En revanche, des études récentes ont montré un intérêt de l’entrainement olfactif. Une étude multicentrique réalisée chez 144 patients avec une dysosmie post-rhinitique virale montrait une amélioration des seuils olfactifs chez 15 à 26% des patients réalisant une stimulation olfactive 4 fois par jour pendant 18 mois (4 odeurs reniflées (rose, eucalyptus, citron, clou de girofle) pendant 15 sec chacune) (Damm M et al. 2014). Des résultats comparables étaient observés chez 42 patients suivis pour dysosmies post-traumatiques (24% d’amélioration de seuils olfactifs après 3 mois de stimulation olfactive par phényléthanol (rose)) (Jiang RS et al.
2017). Des analyses IRM ont montré que l’amélioration des performances olfactives s’accompagnait d’une augmentation du volume des bulbes initialement atrophiés ( Gudziol V et al. 2009).
Enfin la prise en charge de qualité de vie est importante chez des patients pouvant parfois développer un état dépressif. La perte de la convivialité des repas peut entraîner une altération des relations sociales et aboutir à des comportements alimentaire s inadaptés.
Un tableau anxieux peut aussi être observé par le crainte de ne pas sentir des odeurs d’alerte (brûlé, gaz) ou d’être soi-même porteur d’une mauvaise odeur (Kollndorfer K et al. 2017).
Figure 4 : Efficacité des traitements médicaux dans les troubles olfactifs post-rhinitiques (d’après Harless L et al. 2017).
BIBLIOGRAPHIE
Bonfils P. Les troubles de l’odorat. CDRom 2004, Editions Didactik, Lyon, France (réf.600 08 203-code VSC 216/novembre 2013).
Frasnelli J, Landis BN, Heilmann S, Hauswald B, Hüttenbrink KB, Lacroix JS, Leopold DA, Hummel T. Clinical presentation of qualitative olfactory dysfunction. Eur Arch Otorhinolaryngol. 2004 Aug;261(7):411 -5.
Bonfils P, Jankowski R, Werner A. [Smell dysfunction in nasal and paranasal sinus dis ease: a review of the literature]. Ann Otolaryngol Chir Cervicofac. 2001 Jun;118(3):131-42.
Vandenhende-Szymanski C, Hochet B, Chevalier D, Mortuaire G. Olfactory cleft opacity and CT score are predictive factors of smell recovery after surgery in nasal polyposis. Rhinology. 2015 Mar;53(1):29-34.
Stuck BA, Hummel T. Olfaction in allergic rhinitis: A systematic review. J Allergy Clin Immunol. 2015 Dec;136(6):1460-1470.
Harless L, Liang J. Pharmacologic treatment for postviral olfactory dysfunction: a systematic review. Int Forum Allergy Rhinol. 2016 Jul;6(7):760-7.
Lee DY, Lee WH, Wee JH, Kim JW. Prognosis of postviral olfactory loss: follow-up study for longer than one year. Am J Rhinol Allergy. 2014 Sep-Oct;28(5):419-22.
Reden J, Mueller A, Mueller C, Konstantinidis I, Frasnelli J, Landis BN, Hummel T. Recovery of olfactory function following closed head injury or infections of the upper respiratory tract. Arch Otolaryngol Head Neck Surg. 2006 Mar;132(3):265-9.
Murphy C, Schubert CR, Cruickshanks KJ, Klein BE, Klein R, Nondahl DM. Prevalence of olfactory impairment in older adults. JAMA. 2002 Nov 13;288(18):2307-12.
Bianchi AJ, Guépet-Sordet H, Manckoundia P. [Changes in olfaction during ageing and in certain neurodegenerative diseases: up-to-date]. Rev Med Interne. 2015 Jan;36(1):31-7.
Sailani MR, Jingga I, MirMazlomi SH, Bitarafan F, Bernstein JA, Snyder MP, Garshasbi M. Isolated Congenital Anosmia and CNGA2 Mutation. Sci Rep. 2017 Jun 1;7(1):2667.
Dr Geoffrey Mortuaire, Service ORL CHU Lille 2018 13
AltmanKW,DesaiSC,MolineJ,delaHozRE,Herbert R,GannonPJ,DotyRL. Odoridentificationabilityandself- reported upper respiratory symptoms in workers at the post-9/11 World Trade Center site. Int Arch Occup Environ Health. 2011 Feb;84(2):131-7.
Antunes MB, Bowler R, Doty RL. San Francisco/Oakland Bay Bridge Welder Study: olfactory function. Neurology. 2007 Sep 18;69(12):1278-84.
Glennon SG, Huedo-Medina T, Rawal S, Hoffman HJ, Litt MD, Duffy VB. Chronic Cigarette Smoking Associates DirectlyandIndirectlywithSelf-Reported OlfactoryAlterations:Analysisofthe2011-2014NationalHealthand Nutrition Examination Survey (NHANES). Nicotine Tob Res. 2017 Nov 7.
Jafek BW, Linschoten MR, Murrow BW. Anosmia after intranasal zinc gluconate use. Am J Rhinol. 2004 May- Jun;18(3):137-41.
Norès JM, Biacabe B, Bonfils P. [Olfactory disorders and general pathology. Analysis and review of the literature]. Rev Med Interne. 2000 Jan;21(1):95-104.
Chan JYK, García-Esquinas E, Ko OH, Tong MCF, Lin SY. The Association Between Diabetes and Olfactory Function in Adults. Chem Senses. 2017 Dec 25;43(1):59-64.
Kohli P, Soler ZM, Nguyen SA, Muus JS, Schlosser RJ. The Association Between Olfaction and Depression: A Systematic Review. Chem Senses. 2016 Jul;41(6):479-86.
Demarquay G, Ryvlin P, Royet JP. [Olfaction and neurological diseases: a review of the literature]. Rev Neurol (Paris). 2007 Feb;163(2):155-67.
Wilson RS, Arnold SE, Schneider JA, Boyle PA, Buchman AS, Bennett DA. Olfactory impairment in presymptomatic Alzheimer's disease. Ann N Y Acad Sci. 2009 Jul ;1170:730-5.
Rombaux P, Mouraux A, Bertrand B, Nicolas G, Duprez T,Hummel T. Olfactory function and olfactory bulb volume in patients with postinfectious olfactory loss. Laryngoscope 2006a; 116:436–9.