Alcool : quelle prise en charge pour quels objectifs
Alcool : quelle prise en charge pour quels objectifs
Place des psychothérapies et des médicaments ?
Dr Olivier COTTENCIN
Lille
Malgré ce que pourrait laisser entendre l’usage, le traitement de l’alcoolodépendance n’est pas le sevrage. Le traitement de l’alcoolodépendance est plus complet que le sevrage car il vise principalement le phénomène d’addiction.
L’objectif principal du traitement de l’alcoolodépendance a été jusqu’à présent de maintenir l’abstinence à tout prix. Aujourd’hui non seulement il est licite de s’intéresser aux abuseurs (et pas seulement aux dépendants), mais encore il est indispensable de permettre au sujet d’avoir le choix entre l’abstinence ou la gestion des consommations.
Mais est-ce aussi simple ? Car en réalité, le phénomène de l’addiction (très justement défini par la perte du contrôle) permet difficilement d’apprendre à reprendre le contrôle. En effet, apprendre à reprendre un contrôle perdu est un chemin semé d’embuches, liées autant au sujet, qu’au produit et qu’au contexte environnemental. L’objectif thérapeutique sera donc triple car aucun de ces trois facteurs ne prévaut sur l’autre.
Que l’on veuille maintenir l’abstinence à l’alcool ou reprendre une consommation contrôlée en dessous des seuils nocifs, c’est le patient qui est au cœur de ce choix (qui peut toutefois varier avec le temps et les circonstances). Ainsi, autour d’un travail psychosocial conséquent, ce sera par l’association d’un abord psychothérapeutique concret et d’un traitement pharmacologique (parfois mal compris) que le patient pourra tenter d’atteindre les objectifs qu’il se sentira capable d’atteindre.
L’addiction à l’alcool, maladie chronique et récidivante requiert tout d’abord de bien connaître autant les objectifs souhaités que réalisables pour adapter des actions psychothérapeutiques sur mesure et d’y adjoindre des traitements pharmacologiques malheureusement encore insuffisants à ce jour tant en nombre qu’en efficacité.
Pour atteindre les objectifs du patient, le médecin devra autant aborder l’abstinence (ou le contrôle) que la rechute, lutter contre les phénomènes de compensation, intervenir sur les co-addictions, les comorbidités psychiatriques et les comorbidités somatiques. Patients et soignants devront co-construire des stratégies de lutte contre la rechute et une psychothérapie adaptée de la souffrance initiale conforme aux capacités d’introspection.
Quant aux traitements pharmacologiques quatre ont aujourd’hui l’autorisation de mise sur le marché pour le maintien d’abstinence et deux pour la gestion contrôlée.
Après avoir décrit l’abord global du patient, préalable indispensable à une médecine personnalisée le plaçant au centre du processus thérapeutique, nous décrirons quelques outils psychothérapeutiques reconnus et les traitements pharmacologiques actuels (non sans conclure sur les perspectives pharmacothérapeutiques).
Le traitement de l’alcoolodépendance n’est
pas le sevrage
Il
n’est pas rare de confondre le sevrage en boissons alcoolisées avec le
traitement de l’alcoolodépendance. Pourtant de nombreux pays en dehors de la
France considèrent que le sevrage est une situation toxicologique qui doit être
médicalisée (ambulatoire ou résidentiel) puis orientée vers un service
d’addictologie dans un second temps. Cette confusion délétère contribue-t-elle
à l’image de l’échec chronique des soins en Addictologie ? Il est certain
que la rechute précoce est fréquente si l’on se cantonne au sevrage et si l’on
ne profite pas de cette période pour travailler la motivation, la contrainte (Cottencin et al. 2012) et les facteurs de rechute qu’ils soient personnels
(psychopathologiques, psychiatriques), liés au produit et à son mode de
consommation ou encore lié aux facteurs socio-environnementaux.
Ceci
étant, rappelons que les bonnes pratiques du sevrage en boissons alcoolisées
ont pour objectif principal de prévenir l’apparition d’un delirium tremens (état confuso-onirique majeur), les convulsions de
sevrage et les désordres hydroélectrolytiques.
Le
sevrage en boissons alcoolisées est bien codifié depuis longtemps (Société
Française d’Alcoologie 2015) et repose principalement sur une hydratation
suffisante, la prescription de benzodiazépines et de vitamine B1. Il s’agit
d’une prise en charge médicalisée qui s’appuie de façon concertée sur
différents intervenants, selon les situations : médecins généralistes,
addictologues, autres spécialistes (gastroentérologue, ORL, etc.), équipes
hospitalières, infirmières libérales, travailleurs sociaux, mouvements
d’anciens buveurs … (Société Française d’Alcoologie 2015). En
réalité, la plupart des sevrages pourraient être réalisés en ambulatoire,
pourvu que l’on soit assuré d’une excellente compliance, d’une bonne
compréhension du programme de soins, d’une mono-consommation d’alcool, de
l’absence de troubles somatiques ou psychiatriques évolutifs, de l’absence
d’antécédents de crises convulsives ou de delirium tremens, d’un bon réseau de
soins médical et para médical et d’un système de recours d’urgence en cas de
complication (service d’urgences générales, service d’addictologie, de
neurologie, d’hépatologie, etc.). Mais en raison de l’évolution des populations
(comorbidités addictives et psychiatriques plus nombreuses), de nombreux
patients (jusqu’à 30%) (Société Française d’Alcoologie 2006) requièrent une hospitalisation résidentielle
(personnes isolées, environnement conflictuel ou à risque, difficulté
d’observance, comorbidités somatiques ou psychiatriques). Par ailleurs, la
seule demande du patient justifie l’hospitalisation résidentielle (souhait
d’isolement ou séjour de rupture)
Concernant
la technique de sevrage proprement dite, au-delà de mesures environnementales
trop souvent oubliées (réassurance, chambre seule, proche du poste infirmier,
laisser la lumière la nuit) la priorité est à l’hydratation. La voie orale est
préférée et doit être variée (eau, jus de fruit, soupe, sirop, etc.) car
l’apport d’électrolytes est indispensable. Une hydratation de deux à trois
litres par jour est recommandée toutefois sans hyperhydratation. Il n’est
habituellement pas nécessaire de recourir à la voie veineuse, sauf vomissements
incoercibles ou sevrage difficile (associant hypertension artérielle,
tachycardie, hyperventilation, tremblements, sueurs, agitation et troubles
sensoriels). Le score de Cushman (Cushman et al. 1985) - échelle recommandée par le référentiel de bonnes
pratiques cliniques de la Société Française d’Alcoologie - permet à tous les
membres de l’équipe d’objectiver la gravité d’un sevrage et de mesurer son
évolution (tableau 1).
Tableau
1 : Echelle de Cushman
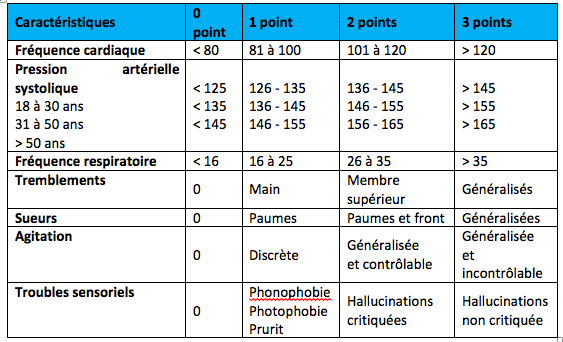
Score
< 7 : état clinique contrôlé / Score 7 à 14 : sevrage modéré / Score > 14
: sevrage sévère
Sur
le plan pharmacologique, les benzodiazépines sont le traitement de référence en
raison de leur effet neuroprotecteur. On privilégie les molécules à demi-vie
longue (diazépam 20 à 40 mg/j en ambulatoire per os) (Paille 2006), mais on peut augmenter ces doses en fonction de
l'importance de la dépendance physique, des co-addictions aux benzodiazépines
fréquentes et de l'efficacité clinique en allant jusqu’à 60 à 80 mg par jour en
hospitalier per os (10 à 20 mg par prise répartis sur 24 heures) (hors AMM). En
cas d’insuffisance hépatocellulaire on recommande l’oxazépam (100 mg/j per os),
mais on peut aller jusqu’à 200 mg par jour (20 mg répartis sur 24 heures) (hors
AMM) (Paille 2006) ou le lorazepam. La durée de ce traitement doit être
limitée dans le temps en raison du risque de dépendance aux benzodiazépines (Griffiths and Wolf 1990). Quoi qu’il en soit, il n’est pas justifié de poursuivre
au-delà de 10 jours (Paille 2006) (sauf cas particuliers comme l’existence de comorbidités
psychiatriques).
Les
antipsychotiques ne sont pas indiqués dans le traitement du sevrage en boissons
alcoolisées, car ils n’ont pas d’action neuroprotectrice et peuvent abaisser le
seuil épileptogène. Mais leur prescription est possible et doit être réservée à
des épisodes délirants accompagnés d’hallucinations invalidantes ou
angoissantes. Aujourd’hui la risperidone (antipsychotique de seconde
génération) peut être prescrite de façon ponctuelle quelques jours, entre 2 et
4 mg sur 24 heures, le soir de préférence, le temps que la symptomatologie
délirante s’amende (Cottencin et al. 2012).
Une
vitaminothérapie B1 est indispensable au moment du sevrage car les malades
dépendants à l’alcool sont souvent carencés. Mais la reprise de la nutrition
(ou une perfusion de sérum glucosé) risquant de mobiliser les réserves de
thiamine pour le métabolisme des hydrates de carbones peut provoquer un
syndrome de Wernicke-Korsakoff. Ainsi en cas de perfusion de sérum glucosé ou
de forte dénutrition, l’administration parentérale peut être requise. Une
posologie de 500 à 1000 mg/j pendant deux semaines est recommandée, en
l’absence de complications neurologiques (Kosten et O’Connor 2003).
En
cas de delirium tremens avéré, le
maintien voire l’augmentation des benzodiazépines, des mesures
environnementales de réassurance et l’ajout d’un antipsychotique de façon
ponctuelle sont recommandées. La contention peut s’avérer nécessaire sous
couvert d’une prescription médicale et d’une surveillance accrue. Mais la
lumière et la parole demeurent un très bon contenant (Cottencin et al. 2012)
Traitement de l’Addiction à l’alcool
Malgré
les polémiques qui ont pu diviser la profession entre l’abstinence ou la
gestion contrôlée de consommation, la véritable question qui se pose aux
patients alcoolodépendants est essentiellement celle de pouvoir se libérer de
l’impossibilité de contrôler sa consommation. En d’autres termes, la véritable
guérison serait de reprendre le contrôle (i.e. « pouvoir boire comme tout
le monde »). Ces polémiques touchent peu ceux qui ont décidé depuis
longtemps de s’appuyer sur le fait clinique et l’expérience des patients. Et
malheureusement, force est de constater que peu de patients en population
clinique hospitalière sont capables de contrôler leur consommation même s’il a
été défini qu’environ 20% d’entre eux le pouvait (Adamson et al. 2010). Une limitation qui est peut-être lié au fait que seuls
20% des patients hospitalisés ne présentent pas de troubles cognitifs
(particulièrement sur les fonctions exécutives) (Société Française d’Alcoologie
2014).
Toutefois
chaque patient doit être informé qu’il a le choix, l’important étant pour chaque
patient de bien connaitre ses capacités afin de bien définir son objectif
thérapeutique et de nous permettre de l’accompagner dans une thérapie sur
mesure, dans laquelle il doit se sentir pleinement acteur.
Ainsi
le travail thérapeutique doit se concentrer sur la lutte contre la rechute, les
envies irrépressibles de boire (craving) et la perte de contrôle … un travail
thérapeutique qui associera pharmacologie et psychothérapie. Les objectifs
thérapeutiques sont donc multiples et dans une dimension motivationnelle
doivent aborder la ré-alcoolisation (voire la rechute), le transfert
d’addiction et les phénomènes de compensation, les co-addictions, les
comorbidités psychiatriques et les comorbidités somatiques. La construction des
stratégies de lutte contre la rechute devant se faire dans le cadre d’une
psychothérapie adaptée à la souffrance exprimée et selon les capacités
d’introspection du patient : elle peut aller de l’accompagnement simple ou
plus intense jusqu’à une psychothérapie structurée.
Organisation de la prise en charge
La
thérapeutique se fonde sur trois points :
-
L’évaluation
attentive de la position du patient consiste à connaître ce qu’il se sent prêt
à faire, ce qu’il se sent capable de faire et ce qu’il paraît capable de
faire ;
-
L’approche
pragmatique est fondée sur la réduction des risques et des dommages de la
consommation d’alcool en s’appuyant sur le désir, la position et la capacité du
patient.
-
Pour
permettre enfin d’organiser l’abord médical, psychologique et social.
L’abord
médical psychologique et social de l’alcoolodépendance doit être l’occasion
d’un bilan complet bien entendu mais surtout global afin de connaître les
ressources du patient et son contexte (autant source de changement que de
frein). Le bilan médical doit dépister toutes les comorbidités les plus
fréquentes (digestives, ORL, hépatiques, neurologiques et carcinologiques), les
autres comorbidités n’étant à rechercher que sur signe d’appel.
Le
dépistage des comorbidités psychiatriques est important en raison des liens
forts entre troubles psychiatriques et troubles addictifs (30 à 50 % des
patients admis en Psychiatrie en Europe présentent un trouble psychiatrique
associé à un abus de substance et 50% des consommateurs de substances
psychoactives souffrent d’au moins un trouble de la personnalité) (Cottencin 2009). De plus, la coexistence d’un trouble de l’usage de
substances chez les patients atteints de trouble psychiatrique est liée à un
devenir clinique plus sombre (Volkow 2009). Toutefois, la comorbidité n’est pas un trouble induit.
En effet, l’alcoolisation chronique est dépressogène et le sevrage peut être
source d’idées suicidaires voire délirantes. La comorbidité (ou diagnostic
associé) est définie par l’OMS comme la co-occurrence chez un même individu
d’un trouble dû à la consommation d’une substance psychoactive et d’un autre
trouble psychiatrique (Valderas et al. 2009). Ainsi deux troubles sont considérés comorbides à la
condition que le diagnostic de chaque trouble puisse être porté indépendamment
et ne pas résulter simplement d’un cluster de symptômes de l’autre trouble. Et
le trouble psychiatrique, pour être indépendant, doit être constitué avant
l’usage de toxiques et persister quatre semaines après l’arrêt de
l’intoxication. Ce n’est qu’après une surveillance de plusieurs semaines après
le sevrage que l’on sera en mesure de diagnostiquer véritablement le trouble
psychiatrique (dépression, psychose, troubles de personnalité …) afin
d’envisager la mise en route d’un traitement psychiatrique spécifique.
Le
dépistage et le traitement des coaddictions associées est également
indispensable pour les mêmes raisons de mauvais pronostic. L’arrêt du cannabis
(co-addiction de plus en plus fréquente) est indispensable au maintien du
sevrage, le tabac (80 % de coaddiction) peut tout à fait être arrêté
simultanément au moyen de tout traitement substitutif à disposition, quant aux
opiacés c’est la substitution opiacée (méthadone, buprénorphine ou
buprénorphine associée à la naloxone) qui sera préférée au sevrage en raison du
risque très important de rechute (95%) et d’overdose à la reprise.
L’accompagnement
social doit être associé au traitement addictologique dès le moment du sevrage
car les patients alcoolodépendants sont très souvent en situation de précarité,
en difficulté professionnelle (s’ils ont encore un travail), voire sans
logement, avec des problèmes judiciaires et souvent ignorants de leurs droits
les plus fondamentaux.
Les abords psychothérapeutiques
Le
pourquoi n’est ni nécessaire, ni suffisant pour changer (Cottencin et al. 2009). En d’autres termes « rechercher les racines d'une
addiction chez une personne se trouvant dans les stades les plus précoces du
changement est comparable à l'attitude d'un ambulancier qui arrivé sur les
lieux d'un accident où les victimes gisent sanguinolentes sur le sol,
chercherait en priorité à mettre en évidence les responsabilités » (Margolis and Zweben 2011)
L’addiction
n’est ni un fléau social, ni un problème moral. L’addiction est une maladie de
la perte du contrôle et des habitudes. Une habitude (au sens des neurosciences)
qui a placé le patient à un équilibre allostatique dont il a peine à se défaire
tant il craint le changement. C’est pourquoi depuis plusieurs années, les
addictologues ont adopté l’approche motivationnelle avant d’envisager un
quelconque programme de soins. En effet, il est inutile (voire délétère) de
lancer un patient dans un travail de lutte contre la rechute s’il n’est pas
dans les meilleures dispositions. L’approche motivationnelle aujourd’hui bien
reconnue (Madson and Campbell 2006) permet de le préparer et repose sur une relation
thérapeutique fondée sur la mise en évidence de l’ambivalence de la demande
(telle que le maintien de la consommation malgré les conséquences négatives),
la balance décisionnelle mesurant les avantages et les inconvénients du
maintien ou de l’arrêt de la consommation, la valorisation de l’efficacité
propre du patient à maintenir l’abstinence, sans jamais que le thérapeute ne
contredise ou n’affronte le patient (la persuasion directe n’est pas la meilleure
approche pour changer), dans une relation d’accompagnement et de confiance
mutuelle. Cette approche permet d’asseoir une meilleure alliance thérapeutique
dans laquelle le sujet garde son libre arbitre, ce qui lui permet de mieux
s’engager dans les soins. Prochaska et Di Clemente (Diclemente and Prochaska
1998) ont
défini 6 stades de changement pour lesquels les attitudes thérapeutiques
doivent s’adapter. Au stade de précontemplation (consommateur n’ayant pas
conscience du trouble) le thérapeute ne peut guère que faire naître le doute,
au stade de contemplation (consommateur indécis) on fera la balance entre les
avantages et les inconvénients de l’arrêt ou de la poursuite de la
consommation. En revanche au stade de détermination (consommateur voulant
changer) on mettra tout en œuvre pour l’aider à accéder aux soins. Puis aux
stades d’action et de maintien des nouveaux comportements, les objectifs
thérapeutiques sont d’apprendre et de renforcer les stratégies de prévention de
la rechute en valorisant toute réussite personnelle. Quant au stade de rechute
(qui est donc intégré dans le processus de changement et donc considéré normal)
on reprendra la balance décisionnelle tout en déculpabilisant le patient lui
expliquant son intérêt comme un nouvel apprentissage.
Les
trois principaux courants psychothérapiques se sont penchés sur la prise en
charge des patients alcoolodépendants : le courant psychanalytique, le courant
cognitivo-comportemental et le courant systémique. L’alexithymie fréquente chez
les patients et la présence plus ou moins importante de troubles cognitifs (en
particulier des fonctions exécutives) ont rendu les approches psychanalytiques
plus complexes face l’aide concrète que l’on doit apporter à ces patients.
Cette approche est clairement affaire de spécialiste. Le courant systémique est
une approche qui s’attache à travailler les situations cliniques sous l’angle
des interactions plus que sous tout autre angle dans une vision pragmatique. En
effet, systémique veut dire que nous sommes dans un système, que nous ne
pouvons pas ne pas communiquer et que nous ne communiquons pas tout seul (Watzlawick 1980). L’approche systémique est donc familiale et
environnementale. Elle consiste à traiter le patient alcoolodépendant en tenant
compte de son environnement proche, souvent en souffrance et demandeur de
changement. L’amélioration du patient va bouleverser le système familial qui
s’était adapté. Car changer implique aussi de déranger un certain agencement
d’individus en interaction, qui se défendent, se réorganisent et ne se laissent
pas facilement manipuler. Une démarche d’autant plus difficile qu’elle concerne
un individu consommant un produit qui change sa vision de la réalité au
quotidien. Pour un patient vivant dans une dépendance totale vis-à-vis de son
entourage, du fait de son addiction, « la guérison » peut avoir des
conséquences difficiles à supporter : arrêter l’alcool c’est aussi reprendre
une vie active, (ré)endosser des responsabilités professionnelles et familiales
(rôle de conjoint, de père, de mère...) (Cottencin et al. 2009)
Quant
aux thérapies cognitives et comportementales Elles sont les plus recommandées (Kadden 2001). Leur hypothèse principale est que les patients ont un
déficit des capacités à répondre au stress par défaut de coping (faire face). Elles proposent de permettre aux patients de
développer des stratégies face aux circonstances susceptibles de favoriser la
reconsommation. Les programmes évaluent les processus cognitifs, les émotions
et les circonstances qui favorisent la consommation d’alcool puis utilisent des
techniques adaptées à chaque situation (exposition, gestion des émotions,
résolution de problèmes, renforcement communautaire) pour permettre un changement
de comportement (Smith, Meyers, and
Delaney 1998).
Il
faut admettre que la tâche est rude pour les patients puisque 40 à 70% d’entre
eux rechutent dans l’année qui suit leur sevrage (Perney, Rigole, and Blanc
2008).
Toutefois le succès dépendra de la personnalisation du programme car comme le
souligne Jean Nicolas Despland il existe une équivalence dans l’efficacité des
psychothérapies qui repose sur trois critères que sont la croyance partagée,
l’alliance thérapeutique et l’expérience du thérapeute (Despland 2010) ce qui nous montre qu’il faut proposer de nombreuses
voies psychothérapeutiques en individuel ou en groupe, avec les associations de
patients, les services de soins de suite
Les pharmacothérapies
A ce
jour, quatre médicaments bénéficient d’une AMM dans le maintien de l’abstinence
chez le sujet alcoolodépendant (Acamprosate, Naltrexone, Baclofène et
Disulfirame) et deux médicaments dans la réduction de consommation (Baclofène
et Nalméfène).
L’acamprosate
agit sur l’activité GABAergique. Il antagonise l’action des acides aminés
excitateurs (glutamate), corrige l’hyperexcitabilité neuronale et régule
activité dopaminergique mésolimbique (circuit de la récompense). Il réduite le
risque de consommer de l’alcool (RR 0,86) et augmente la durée cumulée
d’abstinence (MD 10,94). Son seul effet indésirable plus fréquent que le
placebo est l’existence d’une diarrhée (et des flatulences sont souvent
rapportées). Il est indiqué pour toute forme d’alcoolodépendance, à commencer
dès l’arrêt de l’alcool, il est contre-indiqué en cas d’allaitement et
d’insuffisance rénale. Il est recommandé de le prescrire à la dose de 6
comprimés par jour pendant une durée d’un an.
Le
Naltrexone est un antagoniste des récepteurs opiacés mu et favoriserait la
régulation de l’activité dopaminergique mésolimbique. Il réduit le risque de
consommation massive d’alcool (RR 0,83) et le nombre de jours d’alcoolisation
d’environ 4 % (MD -3,89). De nombreuses études ont été publiées sur son
efficacité avec des résultats malheureusement contradictoires (Perney, Rigole, and Blanc
2008). Une
méta analyse de 2005 montrant même que la naltrexone ne diminuait pas le risque
de récidive de dépendance, mais limitait le nombre de jours de consommation
massive (Srisurapanont and
Jarusuraisin 2005). Les
effets indésirables les plus fréquents sont des nausées et/ou des vomissements,
des céphalées, une sédation ou à l’inverse une insomnie, de l’anxiété, de la
nervosité, des crampes et des douleurs abdominales, articulaires et
musculaires. Parfois une augmentation des taux sériques des transaminases peut
justifier l’arrêt. Il est indiqué dans toute forme d’alcoolodépendance pour
prévenir la rechute, sauf chez les sujets présentant une addiction comorbide
aux opiacés. Il aurait également un effet de prévention des épisodes de binge
drinking. Il est contre-indiqué en cas d’insuffisance hépatique sévère, d’une
dépendance aux opiacés et d’un traitement par substitution opiacée. Notons par
ailleurs qu’il a été démontré que la réponse à la naltrexone (tant chez
l’animal que chez l’homme) puissent être fonction d’un polymorphisme génétique
du récepteur aux opioïdes de type μ. A ce jour, trois études ont montré que les
porteurs de l’allèle G du polymorphisme A118G (rs561720) répondaient
significativement mieux à la naltrexone que ceux porteurs de l’allèle A (Oslin et al. 2003)(Anton et al. 2008)(Kim et al. 2009). En attendant, en l’absence d’analyse pharmacogénétique
de routine la naltrexone est prescrite à la dose de 50 mg/j pendant trois mois
avec une assez bonne tolérance … mais il n’est pas rare de poursuivre au-delà hors
AMM jusqu’à un an parfois.
Le
disulfirame n’est pas un addictolytique, mais une molécule antabuse, utilisée
depuis les années 1950 qui inhibe l’acétaldéhyde déshydrogénase (enzyme
transformant l’acétaldéhyde en acétate). L’augmentation du taux d’acétaldéhyde
chez un malade consommant de l’alcool et du disulfirame se traduit par de
nombreux signes fonctionnels : flushes, nausées, vomissements, céphalée,
vertiges, hypotension artérielle, tachycardie, palpitations. Son efficacité est
reconnue (Hughes and Cook 1997) dans quelques études anciennes (à la méthodologie
limitée). Mais lorsque la prise est supervisée il a un effet sur l’abstinence à
court terme, le nombre de jours avant la rechute et le nombre de jours
d’alcoolisation (Rigal et al. 2012). Aujourd’hui le disulfirame n’est plus guère utilisé en
raison de la crainte d’effets secondaires graves (risque de décès) et de son
obsolescence en ce qu’elle était associée aux cures de dégoût (le renforcement
négatif d’un comportement étant moins efficace que le renforcement positif).
Toutefois on le propose encore pour certains patients demandeurs ou qui ont
déjà connu de bons résultats par le passé sous couvert d’une surveillance
accrue.
Le
baclofène est proposé dans le cadre d’une recommandation temporaire
d’utilisation comme traitement du maintien d’abstinence et de la gestion
contrôlée en association à un suivi psychosocial décidé par le médecin. Il
s'agit d'un myorelaxant agoniste des récepteurs GABA-B, initialement indiqué
dans le traitement de la spasticité musculaire (observée dans les suites d'un
accident vasculaire cérébral, en cas de paraplégie ou dans l'infirmité motrice
cérébrale, …) (Greene 1992). La dose maximale per os au-delà de laquelle il n’a pas
été noté d’effets secondaires limitants est de 75 mg/j (Greene 1992)(Ameisen 2005). Les effets
indésirables les plus fréquents sont la somnolence ou la faiblesse musculaire
qui souvent régressent en 24 ou 48 heures (Ameisen 2005). Les études d’efficacité demeurent contradictoires (en
grande partie liée à des différences d’objectif principal) quant aux études de
sécurité (trop rares), l’une d’entre elle a récemment inquiété l’ANSM à tel
point que l’agence est revenue sur la RTU pour demander que la dose de 80 mg/j
ne soit pas dépassée … ce qui n’a pas été sans conséquences (accidents de
sevrage ou rechutes …) pour les patients traités efficacement à des doses bien
supérieures et bien tolérées qui ont été contraints de diminuer brutalement les
doses.
Concernant
les contre-indications, alors qu’elles étaient nombreuses lors de la première
RTU, il est aujourd’hui seulement recommandé d’être prudent chez les patients
présentant des troubles psychiatriques, une épilepsie, une polyaddiction, une
insuffisance rénale, hépatique, cardiaque, une maladie de Parkinson, un ulcère
gastroduodénal, etc.
En
attendant les décisions de l’ANSM sur une AMM définitive, nous avons proposé au
sein de notre Consultation d’Avis Multidisciplinaires de Traitements
d’Exception en Addictologie (CAMTEA) un programme spécifique de prescription
hors AMM du baclofène chez les patients alcoolodépendants ayant déjà reçu
acamprosate ou naltrexone sans efficacité. Dans le souhait d’endiguer les
prescriptions sauvages et les automédications (avec les risques de surdosage ou
de coprescriptions inappropriées), nous proposons depuis quelques années avec
l’aide de la pharmacovigilance du CHU de Lille et des addictologues de la
région de suivre rigoureusement toutes les prescriptions de la région. Ce
protocole qui est disponible pour tous (Rolland et al. 2010) est opérationnel pour d’autres molécules, dans d’autres
indications. A ce jour nous proposons à l’instar de la SFA, une phase de
titration en fractionnant en 3 prises par jour avec pour objectif de chercher
la plus faible dose permettant à la fois une réponse clinique et une tolérance
optimales. La posologie initiale est de 15 mg/j, suivie d’une augmentation de
posologie de 5 mg tous les deux jours entre 15 à 30 mg/j puis à partir de 30
mg/j nous proposons d’augmenter de 10 mg tous les 3 jours jusqu’à apparition de
l’effet thérapeutique. A partir de la dose de 120 mg/j, le prescripteur doit
solliciter l’avis d’un médecin expérimenté dans la prise en charge de
l’alcoolo-dépendance (Société Française d’Alcoologie 2015)(Société Française
d’Alcoologie 2015). La
posologie maximum est de 300 mg/j mais l’ANSM y est franchement opposée et
reste sur l’idée de ne pas dépasser 80 mg/j en raison du risque accru de
mortalité au-delà. La Société Française d’Alcoologie dans un communiqué du mois
d’aout 2017 a proposé raisonnablement en raison du risque encouru pour les
patients bénéficiant du baclofène
1.
de ne pas
initier de prescription de baclofène supérieure à 80 mg/j, conformément à la
demande de l’ANSM ;
2.
pour les
patients bénéficiant actuellement d’une prescription de baclofène à des doses
supérieures à 80 mg/j, considérée bien tolérée et efficace : d’informer les
patients sur les risques de mortalité aux doses élevées et d’accroitre la
surveillance de la prescription, de ne pas modifier les doses, ou de rechercher
avec prudence une dose minimale efficace ;
3.
pour les
patients bénéficiant actuellement d’une prescription de baclofène (quelle que
soit la dose) considérée comme mal tolérée ou inefficace ou pour tout patient
désireux de diminuer les doses : de se rapprocher de leur prescripteur et
d’engager en concertation (patient, pharmacien, médecin) une diminution
progressive du baclofène de 15 mg par semaine, jusqu’à une dose minimale
efficace bien tolérée, voire jusqu’à l’arrêt (Société Française d’Alcoologie
2017).
L’effet
thérapeutique recherché est une indifférence à l’alcool, une diminution du
craving voire une reprise du contrôle des consommations … Les effets
secondaires les plus fréquents sont une somnolence, des nausées et une
confusion (de surdosage comme de sevrage).
Quant
au Nalméfène, il s’agit d’un antagoniste des récepteurs mu et delta et d’un
agoniste partiel des récepteurs kappa. Il a une durée d’action plus longue et
une moindre hépatotoxicité que la naltrexone. L’effet thérapeutique attendu est
une réduction du craving de récompense (associé aux récepteurs mu) et de la
dysphorie (associée aux récepteurs kappa). Les effets secondaires les plus
fréquents sont une insomnie, des vertiges, des céphalées et des nausées. La
posologie usuelle est de 1 cp/j de façon systématique ou deux heures avant de
boire.
D’autres
traitements ont montré une action contre le craving. C’est le cas notamment du
topiramate (Johnson and Ait-Daoud
2010) un
anticonvulsivant qui augmente l’activité GABAergique et inhibe l’activité
glutamatergique, ce qui a pour conséquence de diminuer le relargage de dopamine
dans le circuit mésocorticolimbique (Perney, Rigole, and Blanc
2008).
L’ondansetron, antiémétique, antagoniste sélectif de la sérotonine, aurait
quant à lui un effet positif pour le maintien de l’abstinence et la diminution
de la consommation moyenne (Johnson et al. 2000).
Pour conclure
Aujourd’hui
dans le traitement de l’addiction à l’alcool, l’objectif thérapeutique est
clairement tourné vers la préférence du patient (abstinence ou gestion
contrôlée) et le dogme de l’abstinence comme seule solution est abandonné au
profit de la qualité de vie et de l’analyse motivationnelle. L’alliance
thérapeutique, le soutien de l’environnement, les interventions
psychothérapeutiques spécialisées (loin de tout causalisme) associés au
traitement pharmacologique est la démarche la plus adaptée comme le montre la
figure 1 inspirée des recommandations 2015 de la SFA.
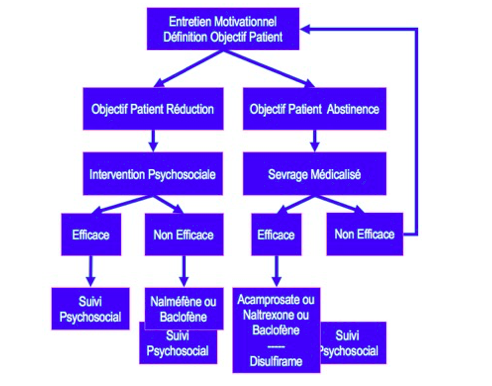
Figure
1 : Arbre décisionnel du traitement de l’addiction à l’alcool
d’après
la conférence de consensus de la SFA (2015)
Toutefois,
nous manquons encore d’outils thérapeutiques novateurs (TERV, nouvelles
thérapies de groupes, nouvelles molécules, pharmacogénétique en pratique
courante). Fort des connaissances en Neurosciences, nous pouvons dire que
l’addiction est un apprentissage non souhaité en désaccord avec les choix existentiels
(Isebaert 2009), un apprentissage qui s’automatise et reste disponible
même après des années d’abstinence. Nos pistes de travail sont de permettre à
nos patients, en tenant compte de leurs propres leviers motivationnels,
d’apprendre de nouvelles habitudes, particulièrement dans le contexte qui
favorisait l’apparition des anciennes. L’abstinence n’est pas un but en soi,
mais un moyen. Le patient en est le seul acteur.
Références
Adamson, Simon J., Nick Heather,
Veronica Morton, Duncan Raistrick, et UKATT Research Team. 2010. « Initial
Preference for Drinking Goal in the Treatment of Alcohol Problems: II.
Treatment Outcomes ». Alcohol and Alcoholism (Oxford, Oxfordshire)
45 (2):136‑42.
https://doi.org/10.1093/alcalc/agq005.
Ameisen, Olivier. 2005. « Complete and Prolonged Suppression of
Symptoms and Consequences of Alcohol-Dependence Using High-Dose Baclofen: A
Self-Case Report of a Physician ». Alcohol and Alcoholism (Oxford,
Oxfordshire) 40 (2):147‑50.
https://doi.org/10.1093/alcalc/agh130.
Anton, Raymond F., Gabor Oroszi, Stephanie O’Malley, David Couper,
Robert Swift, Helen Pettinati, et David Goldman. 2008. « An Evaluation of
Mu-Opioid Receptor (OPRM1) as a Predictor of Naltrexone Response in the
Treatment of Alcohol Dependence: Results from the Combined Pharmacotherapies
and Behavioral Interventions for Alcohol Dependence (COMBINE) Study ». Archives
of General Psychiatry 65 (2):135‑44.
https://doi.org/10.1001/archpsyc.65.2.135.
Cottencin, O. 2009. « [Severe
depression and addictions] ». L’Encephale 35 Suppl 7
(décembre):S264-268. https://doi.org/10.1016/S0013-7006(09)73483-9.
Cottencin, O., Y. Doutrelugne, M.
Goudemand, et S. M. Consoli. 2009. « [Addiction and brief-systemic therapy:
working with compulsion] ». L’Encephale 35 (3):214‑19. https://doi.org/10.1016/j.encep.2008.06.002.
Cottencin, Olivier, Dewi Guardia, Laurent Karila, et Benjamin Rolland.
2012. « [Clinical alcohology] ». Presse Medicale (Paris, France:
1983) 41 (12 Pt 1):1248‑58.
https://doi.org/10.1016/j.lpm.2012.07.032.
Cushman, P., R. Forbes, W.
Lerner, et M. Stewart. 1985. « Alcohol Withdrawal Syndromes: Clinical
Management with Lofexidine ». Alcoholism,
Clinical and Experimental Research 9
(2):103‑8.
Despland, Jean-Nicolas. 2010.
« Quelle psychothérapie pour quel patient ? Données de recherche et
problèmes cliniques ». Psychotropes 16 (2):9.
https://doi.org/10.3917/psyt.162.0009.
Diclemente, CC, et JO Prochaska. 1998. « Toward a
comprehensive, transtheoretical model of change: stages of change and addictive
behaviors ». In Treating addictive behaviors. 2nd ed., 3‑24. New York: Miller WR and Heather N.
Greene, P. 1992. « Baclofen in the Treatment of Dystonia ». Clinical Neuropharmacology 15 (4):276‑88.
Griffiths, R. R., et B. Wolf.
1990. « Relative
Abuse Liability of Different Benzodiazepines in Drug Abusers ». Journal
of Clinical Psychopharmacology 10 (4):237‑43.
Hughes, J. C., et C. C. Cook. 1997. « The Efficacy of Disulfiram: A
Review of Outcome Studies ». Addiction
(Abingdon, England) 92 (4):381‑95.
Isebaert, Luc. 2009.
« Méthode et évaluation du modèle solutionniste de Bruges ». In Thérapies
brèves : situations cliniques. Pratiques en psychothérapie., Masson, 125‑43. Paris: Doutrelugne Y, Cottencin O.
Johnson, B. A., J. D. Roache, M.
A. Javors, C. C. DiClemente, C. R. Cloninger, T. J. Prihoda, P. S. Bordnick, N.
Ait-Daoud, et J. Hensler. 2000. « Ondansetron for Reduction of Drinking
among Biologically Predisposed Alcoholic Patients: A Randomized Controlled
Trial ». JAMA 284 (8):963‑71.
Johnson, Bankole A., et Nassima Ait-Daoud. 2010. « Topiramate in
the New Generation of Drugs: Efficacy in the Treatment of Alcoholic
Patients ». Current Pharmaceutical Design 16 (19):2103‑12.
Kadden, R. M. 2001. « Behavioral and Cognitive-Behavioral
Treatments for Alcoholism: Research Opportunities ». Addictive
Behaviors 26 (4):489‑507.
Kim, Sung-Gon, Cheol-Min Kim, Sam-Wook Choi, Young-Myo Jae, Hae-Gook
Lee, Bong-Ki Son, Jeong-Gee Kim, et al. 2009. « A Micro Opioid Receptor
Gene Polymorphism (A118G) and Naltrexone Treatment Response in Adherent Korean
Alcohol-Dependent Patients ». Psychopharmacology 201 (4):611‑18. https://doi.org/10.1007/s00213-008-1330-5.
Kosten, Thomas R., et Patrick G. O’Connor. 2003. « Management of
Drug and Alcohol Withdrawal ». The New England Journal of Medicine
348 (18):1786‑95.
https://doi.org/10.1056/NEJMra020617.
Madson, Michael B., et Todd C. Campbell. 2006. « Measures of
Fidelity in Motivational Enhancement: A Systematic Review ». Journal of
Substance Abuse Treatment 31 (1):67‑73. https://doi.org/10.1016/j.jsat.2006.03.010.
Margolis, RD, et JE Zweben. 2011. « Treating
Patients With Alcohol and Other Drug Problems: An Integrated Approach, Second
Edition ». http://www.apa.org. 2011. http://www.apa.org/pubs/books/4317263.aspx.
Oslin, David W., Wade Berrettini, Henry R. Kranzler, Helen Pettinati,
Joel Gelernter, Joseph R. Volpicelli, et Charles P. O’Brien. 2003. « A
Functional Polymorphism of the Mu-Opioid Receptor Gene Is Associated with
Naltrexone Response in Alcohol-Dependent Patients ». Neuropsychopharmacology:
Official Publication of the American College of Neuropsychopharmacology 28
(8):1546‑52.
https://doi.org/10.1038/sj.npp.1300219.
Paille, Francois. 2006.
« Traitement médicamenteux du sevrage alcoolique et de l’aide au maintien
de l’abstinence ». In Traité d’Addictologie, Médecine-Sciences
Flammarion, 418‑24.
Paris: Reynaud, M.
Perney, P., H. Rigole, et F.
Blanc. 2008.
« [Alcohol dependence: diagnosis and treatment] ». La Revue De Medecine Interne 29 (4):297‑304.
https://doi.org/10.1016/j.revmed.2007.09.026.
Rigal, Laurent, Constance
Alexandre-Dubroeucq, Renaud de Beaurepaire, Claire Le Jeunne, et Philippe
Jaury. 2012.
« Abstinence and “low-Risk” Consumption 1 Year after the Initiation of
High-Dose Baclofen: A Retrospective Study among “High-Risk” Drinkers ». Alcohol
and Alcoholism (Oxford, Oxfordshire) 47 (4):439‑42. https://doi.org/10.1093/alcalc/ags028.
Rolland, Benjamin, Sylvie Deheul,
Thierry Danel, Régis Bordet, et Olivier Cottencin. 2010. « [A system of
prescriptions without drug approval: example of baclofen] ». Therapie 65
(6):511‑18.
https://doi.org/10.2515/therapie/2010073.
Smith, J. E., R. J. Meyers, et H.
D. Delaney. 1998. « The Community Reinforcement Approach with Homeless
Alcohol-Dependent Individuals ». Journal
of Consulting and Clinical Psychology 66
(3):541‑48.
Société Française d’Alcoologie.
2006. « Évaluation des pratiques professionnelles en Alcoologie. Référentiel de bonnes pratiques cliniques.
Sevrage simple en alcool. »
———. 2014. « Troubles de
l’usage de l’alcool et troubles cognitifs ». Alcoologie et Addictologie,
2014, sect. 36 (4).
———. 2015. « Mésusage de
l’alcool dépistage, diagnostic et traitement. Recommandation de bonne
pratique ». Alcoologie et Addictologie, 2015, sect. 37 (1).
———. 2017. « Communiqué de
la Société Française d’Alcoologie du 2 aout 2017 », 2017.
http://www.sfalcoologie.asso.fr/download/SFA-CP_Baclofene_ANSM-2017_08_02.pdf.
Srisurapanont, Manit, et Ngamwong
Jarusuraisin. 2005. « Naltrexone for the Treatment of Alcoholism: A Meta-Analysis
of Randomized Controlled Trials ». The International Journal of
Neuropsychopharmacology 8 (2):267‑80.
https://doi.org/10.1017/S1461145704004997.
Valderas, Jose M., Barbara Starfield, Bonnie Sibbald, Chris Salisbury,
et Martin Roland. 2009. « Defining Comorbidity: Implications for
Understanding Health and Health Services ». Annals of Family Medicine
7 (4):357‑63.
https://doi.org/10.1370/afm.983.
Volkow, Nora D. 2009. « Substance Use Disorders in
Schizophrenia--Clinical Implications of Comorbidity ». Schizophrenia Bulletin 35
(3):469‑72.
https://doi.org/10.1093/schbul/sbp016.
Watzlawick, P. 1980. Le
langage du changement. Paris: Seuil.
Professeur Olivier COTTENCIN
Université de Lille – CHU de Lille
SCALab Equipe PsyCHIC CNRS UMR 9193
Coordonnateur Interrégional du DESC d’Addictologie
Responsable du Service d’Addictologie
Hôpital Fontan 2
1, rue André Verhaeghe 59000 Lille
+ 33 3 20 44 58 38
olivier.cottencin@chru-lille.fr