Les perturbateurs endocriniens.
Les perturbateurs endocriniens et leurs conséquences
Ces substances sournoises
disséminées dans notre quotidien et leurs conséquences.
Dr Patricia Bartaire, Pédiatre endocrinologue, cabinet BLM, 59130 Lambersart,
Médecin attaché au CHU de Lille, Membre de la SFEDP et de l’AFPEL.
1/ Définitions des perturbateurs endocriniens
environnementaux (PEE)
-Définition des PEE : 1ère définition scientifique dés 1991
Dés les années 80, des études sur l’animal ont été menées pour étudier la toxicité endocrinienne de certaines substances chimiques comme les phtalates [1,2]. En 1991, la réunion scientifique de Wingspread (US) a défini l’existence de nombreux composés libérés dans l'environnement par les activités humaines capables de dérégler le système endocrinien des animaux et de l'homme [3].
-Principes de toxicité spécifique aux PEE : définitions
toujours en cours…
Tous les scientifiques s’accordent sur cette première définition établie dans les années 90 mais… Il reste à créer une nouvelle catégorie de toxiques pour la santé et à développer des nouveaux modèles de recherche [4]. En effet, l’action des PEE ne correspond à aucun autre type de toxique connu jusque maintenant et sur ce point les instances scientifiques, politiques et législatives se battent encore.
De nouveaux principes de recherche ont été établis [5]. Vous trouverez un résumé en français Figure 1.
2/ Impacts sur la santé connus et suspectés des PEE
Les effets connus des PEE sont multiples (malformations génitales du garçon, obésité, cancers du sein et du testicule, infertilité masculine et féminine, atteintes de la fonction intestinale) [6,7,8]. Notre corps n’est pas une barrière imperméable, nous pouvons être contaminé par voie respiratoire, digestive ou cutanée. Le fœtus peut être contaminé pendant la grossesse.
- Exemple 1 : activité oestrogénique et PEE
Rappel sur l’action des œstrogènes : la biosynthèse des œstrogènes a lieu dans l’ovaire, le placenta, le foie, la peau, le tissu adipeux, le cerveau.
Quels sont les PEE à activité oestrogénique ? 1/ E2 naturels, 2/ E2 utilisés comme médicaments, 3/ Xéno-oestrogènes, polluants 4 /Obésité, insuline et activité oestrogénique : les PEE et le surpoids : quelles interactions ?
Exemples
de la pédiatrie :
- Etudes sur les effets des PEE sur le développement des voies génitales masculines et féminines [9].
- Augmentation des pubertés précoces : on constate une augmentation des cas de pubertés précoces et d’un âge plus précoce de thélarche chez les filles (poussée mammaire) et lien entre puberté précoce et PEE fortement suspecté [10-14].
L’étude de
l’activité oestrogénique chez l’enfant est complexe en pratique qu’il s’agisse
d’œstrogènes naturels ou de xéno-estrogènes [15].
- Exemple 2 : tissu adipeux et PEE : une interaction
privilégiée
En cas d’obésité on constate une augmentation du risque relatif de gynécomastie, de cancers hormono-dépendants, de poussée mammaire précoce de la petite fille, de SOPK, d’infertilité…Quels en sont les mécanismes ?
Le tissu adipeux est une zone de régulation de l’activité de
l’insuline et de sécrétion des E2 endogènes. C’est aussi un lieu de stockage
des PEE qui sont en général lipophiles. Le tissu adipeux relargue ces PEE tout
au long de la vie, y compris de la mère au fœtus.
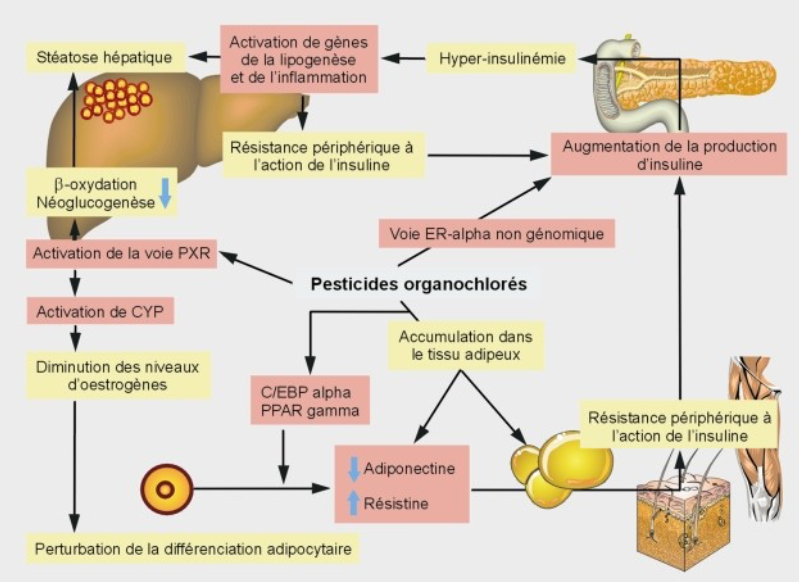
Les PEE ont probablement un rôle dans l’apparition de l’obésité et des maladies métaboliques [16,17,18]. Des études récentes montrent les interactions entre phtalates et organochlorés avec la cellule adipeuse [19,20]. Figure 2.
3/ Législation, décisions politiques
Nombreux sont les décideurs politiques à l’échelle
nationale ou européenne pouvant intervenir dans la commercialisation des
produits contenants des PEE. Les différents groupes de
pressions s’affrontent sur ce
sujet depuis plus de 20 ans.
Les principes de toxicité des PEE ne correspondent pas aux notions anciennes liées aux autres catégories de toxiques [5] : en ce qui concerne les PEE la notion de seuil de toxicité est obsolète et de nouveaux principes d’études et de recherche doivent être utilisés. Or les agences européennes persistent à vouloir utiliser des seuils de toxicité ce qui n’est pas adapté aux PEE et ralenti leur interdiction complète.
En France : les décideurs ont beaucoup mieux pris la mesure des enjeux de santé publique liés aux PEE et aux nouveaux défis pour les scientifiques qui souhaitent en analyser leurs effets, totalement différents des autres toxiques connus. En 2014 le ministère de l’écologie met en place «la stratégie nationale sur les perturbateurs endocriniens »[21]. L’étude nationale de cohorte ELFE évalue la contamination des femmes enceintes et bébés français nés en 2011 [22].
4/ Quelle prévention auprès des familles ?
Il existe actuellement suffisamment d’éléments scientifiques pour ne plus retarder la mise en œuvre du principe de précaution :
- Le médecin s’informe lui-même régulièrement des nouvelles données scientifiques au sujet des PEE.
- Le médecin
informe les parents sur la responsabilité très probable de facteurs
environnementaux dans de nombreuses maladies. La prévention ne doit pas
concerner que la femme enceinte ou le jeune enfant.
- Il faut toujours penser à rechercher avant tout une cause organique (comme dans la puberté précoce par exemple) avant d’incriminer des facteurs environnementaux.
- On peut dés à présent aider les familles à élaborer des stratégies pour limiter l’exposition aux différentes sources de PEE tout au long de la vie et limiter la prise de poids en raison du rôle probable du tissu adipeux dans la potentialisation des effets des PEE.
Figure 1 : Principes fondamentaux des PEE d’après Endocrine Principles Applied to EDC Research.
Recommendations for the future [5] (Zoeller et al. Endocrinology. 2012)

Schéma
des différents hypothèses mécanistiques pouvant expliquer le lien entre
exposition aux
Organochlorés
et développement d’un syndrome métabolique ou d’un diabète de type 2.
Différenciation
adipocytaire
et sa production de cytokines/adipokines sont perturbées par des doses assez
élevées
d’organochlorés (OC) (DDT, aldrine, endrine, dieldrine) [19,20]
Bibliographie :
1- Gray TJ, Rowland IR, Foster PM, Gangolli SD. Species differences in the testicular toxicity of phthalate esters. Toxicol Lett. 1982 Apr;11(1-2):141-7.
2- Foster PM, Thomas LV, Cook MW, Walters DG. Effect of DI-n-pentyl phthalate treatment on testicular steroidogenic enzymes and cytochrome P-450 in the rat. Toxicol Lett. 1983 Feb;15(2-3):265-71.
3- Skakkebaek NE, Rajpert-De Meyts E, Main KM. Testicular dysgenesis syndrome: an increasingly common developmental disorder with environmental aspects. Hum Reprod. 2001 May;16(5):972-8.
4- Hotchkiss AK, Rider CV, Blystone CR, Wilson VS, Hartig PC, Ankley GT, Foster PM, Gray CL, Gray LE. Fifteen years after "Wingspread"--environmental endocrine disrupters and human and wildlife health: where we are today and where we need to go. Toxicol SCI. 2008 Oct;105(2):235-59. doi: 10.1093/toxsci/kfn030. Epub 2008 Feb 16.
5- Zoeller
RT1, Brown TR, Doan LL, Gore AC, Skakkebaek NE, Soto AM, Woodruff TJ, Vom Saal
FS. Endocrine-disrupting chemicals and public health protection: a statement of
principles from The Endocrine Society. Endocrinology. 2012
Sep;153(9):4097-110. doi: 10.1210/en.2012-1422. Epub 2012 Jun 25.
6- De Coster S, van Larebeke N. Endocrine-disrupting chemicals: associated disorders and mechanisms of action. J Environ Public Health. 2012;2012:713696. Epub 2012 Sep 6.
7- Slama R, Bourguignon JP,
Demeneix B, Ivell R, Panzica G, Kortenkamp A, Zoeller T. Scientific Issues
Relevant to Setting Regulatory Criteria to Identify Endocrine Disrupting
Substances in the European Union. Environ Health Perspect. 2016 Apr 25.
8- Trasande L, Zoeller, Hass,
Kortenkamp, Grandjean, Myers, DiGangi
Hunt, Rudel, Sathyanarayana
Bellanger, Hauser, Legler J, Skakkebaek, Heindel. Burden of disease and
costs of exposure to endocrine disrupting chemicals in the European Union: an
updated analysis. Andrology.
2016 Mar 22. doi: 10.1111/andr.12178.
9- Costa EM, Spritzer PM, Hohl A, Bachega TA. Effects of endocrine disruptors in the development of the female reproductive tract. Arq Bras Endocrinol Metabol. 2014 Mar;58(2):153-61.
10- Colon I et al (2000) Identification of phtalate esters in the serum of
young Puerto Rican girls with premature breast development, Environ Health
Perspect 108 (9): 895-900
11- Vasiliu O (2004) In utero exposure to organochlorines and age at menarche. Human
Reproduction (Oxford, England) 19 (7): 1506-12.
12- Krstevska-Konstantinova M. (2001) Sexual precocity after immigration from
developing countries to Belgium: evidence of previous exposure to
organochlorine pesticides. Hum Reprod 16: 1020-6.
13- Durmaz E (2014) Urinary Bisphenol A levels in girls with idiopathic central
precocious puberty. J Clin Res Pediatr Endocrinol 2014, 6(1): 16-21.
14- Paris F. Increased serum estrogenic bioactivity in girls with premature thelarche: a marker of environmental pollutant exposure? Gynecol Endocrinol. 2013 Aug;29(8):788-92.
15- Aksglaede L,
Juul A, Leffers H, Skakkebaek NE, Andersson AM. The sensitivity of the child to
sex steroids: possible impact of exogenous estrogens. Hum Reprod Update.
2006 Jul-Aug;12(4):341-9. Epub 2006 May 3.
16- Henriksen GL, Ketchum NS,
Michalek JE, Swaby JA. Serum dioxin and diabetes mellitus in veterans of
Operation Ranch Hand. Epidemiology. 1997; 8:252258
17- Kern PA, Said S, Jackson WG, JR, Michalek JE. Insulin sensitivity
following agent orange exposure in Vietnam veterans with high blood levels of
2,3,7,8-tetrachlorodibenzo-p-dioxin. J Clin Endocrinol Metab. 2004; 89:46654672
18- Fujiyoshi PT, Michalek
JE, Matsumura F. Molecular epidemiologic evidence for diabetogenic effects of
dioxin exposure in U.S. Air force veterans of the Vietnam war. Environ
Health Perspect. 2006; 114:16771683
19-
Moreno-Aliaga MJ, Matsumura F. Endrin inhibits adipocyte differentiation by
selectively altering expression pattern of CCAAT/enhancer binding protein-alpha
in 3T3-L1 cells. Molecular pharmacology. 1999; 56:91101
20- Howell G, III, Mangum L.
Exposure to bioaccumulative organochlorine compounds alters adipogenesis, fatty
acid uptake, and adipokine production in NIH3T3-L1 cells. Toxicol In. 2011;
25:394402
21- Texte complet on line: http://www.developpement-durable.gouv.fr/IMG/pdf/2014-04-29_Strategie_Nationale_Perturbateurs_Endocriniens.pdf
22- Dereumeaux C, Saoudi A, Pecheux M, Berat B, de Crouy-Chanel P, Guldner L. Biomarkers of exposure to environmental contaminants in French pregnant women from the Elfe cohort in 2011. Environ Int. 2016 Dec;97:56-67. doi:10.1016/j.envint.2016.10.013. Epub 2016 Oct 24.