Remplacement valvulaire sans sternotomie : actualité et nouveautés, quelles indications?
Dr Maxence DELOMEZ
Polyclinique du Bois – Lille
Le TAVI est l'acronyme de « Transcatheter
Aortic Valve Implantation ». C'est une technique de traitement récente du
rétrécissement valvulaire aortique (RAo), correspondant au traitement de cette
pathologie par cathétérisme interventionnel percutané et non chirurgicalement,
comme classiquement.
Le RAo est une maladie fréquente du sujet âgé
lié au développement de dépôts athéromateux, sténosant la valve aortique.
Ce RAo génère juste un souffle cardiaque,
aortique systolique éjectionnel : sans symtôme pendant de nombreuses
années, quand il devient serré, apparaissent dyspnée d'effort, angor d'effort
et syncope d'effort puis les complications (troubles conductifs, insuffisance
cardiaque,…).
A partir du stade symptomatique, le Rao est
serré et le pronostic vital du patient est engagé, entre quelques années et
quelques mois voire semaines, selon l'intensité et la sévérité des
complications. Ce stade de « Rao serré » est en phase avec des
critères échocardiographiques : Vmax > 4 m/s et/ou gradient moyen VG/aorte>
40 mmHg et/ou une surface valvulaire aortique < 0,75 cm².
C'est à ce stade, de Rao serré, qu'il faut donc intervenir.

Le traitement jusqu’à présent recommandé est le
remplacement valvulaire aortique chirurgical sous circulation extra-corporelle
(CEC), par valve mécanique ou bioprothèse (selon l’âge et la possibilité de
prendre des anti-coagulants). 12 à 15 000 patients sont soignés chirurgicalement
annuellement en France d'un RAo serré. C'est un traitement ancien, évalué,
validé, maitrisé, avec d'excellents résultats et une moyenne de mortalité entre
2 et 4 %.
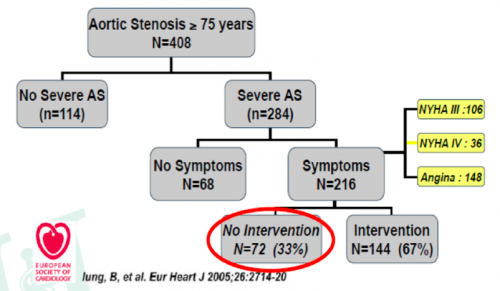
Toutefois, beaucoup de patients ont un risque opératoire plus élevé du fait de co-morbidités (âge avancé, AVC, artérite, SAS et BPCO, obésité, antécédents coronariens, atteinte multivalvulaire, insuffisance cardiaque, cirrhose,…) et pour ces patients, le risque opératoire est beaucoup plus élevé. Beaucoup (33%) sont même contre-indiqués à la chirurgie du fait d'une contre-indication ou d'un trop haut risque opératoire :
C'est la raison pour laquelle, dès les années 80, des traitements
alternatifs à la chirurgie ont été entrepris. En 1986, le Professeur Alain
CRIBIER (Rouen), publiait le premier cas de dilatation per-cutanée de la valve
aortique, simplement au ballonnet (Lancet. 1986 Jan
11;1(8472):63-7). Cette technique ne donnait pas de très bons résultats ni immédiats
ni à terme, et a vite été abandonnée. Avec les progrès technologiques, A.
Cribier, croyant toujours à sa technique, imagina alors de coudre une
bioprothèse dans un grand stent, à déployer par un ballonnet : c’est le
TAVI, qu’il a pu implanter pour la première fois en avril 2002 (Cribier Circulation. 2002; 106: 3006-3008). Une
autre valve, dans un stent auto-expandable fût expérimentée et implantée chez
l’homme en 2004.

Après ces premiers cas humains, ces techniques ont été évaluées par
le biais de registres (France et France 2 pour les 11 puis 33 centres français
autorisés) et d'études randomisées qui ont permis le développement du TAVI du
fait des bons résultats.
La première étude randomisée sur le TAVI, PARTNER B, a randomisé 360 patients inopérables, entre TAVI et traitement médical : la mortalité à 1 an était réduite de 45% grâce au TAVI. Le TAVI devenait alors la technique de référence du traitement du rétrécissement aortique chez le patient inopérable.
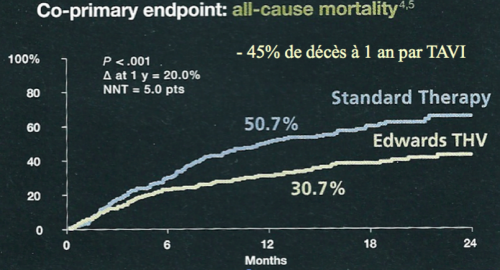
(Leon MB, Smith CR, Mack M, et
al. Transcatheter aortic-valve implantation for aortic stenosis in patients who
cannot undergo surgery. N Engl J Med. 2010;363;1597-1607)
Il s’agissait pourtant de la première
génération de valves, les praticiens étaient peu expérimentés, les techniques
de mesure d’anneau aortique et de choix de TAVI encore mal maitrisées.
Les valves se sont améliorées, l’expérience des
opérateurs a augmenté, et surtout, on a appris à choisir la valve et la voie
d’abord grâce au scanner.
On a alors vu décroître, grâce à ces progrès,
les complications du TAVI.
En 2014, le TAVI faisait la preuve de sa
supériorité chez les patients à haut risque opératoire et opérables, avec
réduction significative de la mortalité toutes causes confondues à 1 an, dans
le groupe TAVI par rapport au groupe opéré.
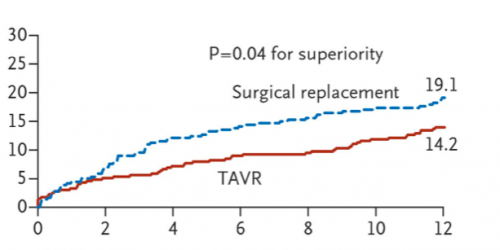
(Adams Transcatheter
Aortic-Valve Replacement with a Self-Expanding Prosthesis N Engl J Med 2014; 370:1790-1798)
Les indications se sont donc élargies au patients à risque élevé voire intermédiaire, mais aussi au « valve in valve »,… Les textes et la réglementation se sont adaptés. Les cathéters s’améliorent encore, plus profilés, les valves deviennent plus précises, repositionnables, et possèdent maintenant des systèmes réduisant les fuites péri-prothétiques, l’ensemble laissant entrevoir une amélioration supplémetaire des résultats et une extension (encore ?) des indications. Des études (PARTNER 3, SURTAVI,…) sont réalisées en ce sens chez les patients opérables risque intermédiaire et faible.
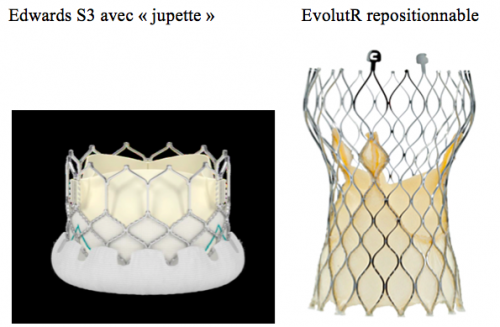
Le développement et l’extension des indications est conforté par l’obtention, à présent, d’un recul important sur un nombre significatif de patients : les résultats montrent un excellent comportement de ces TAVI au fil des ans, sans modifications des gradients ni des surfaces :
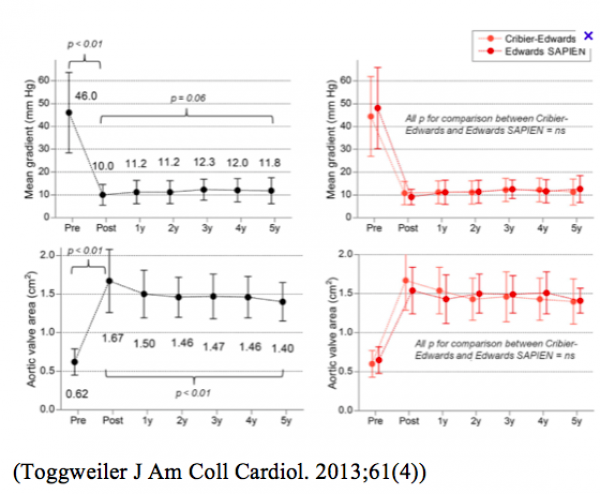
L’activité des 50 centres actuellement
autorisés en France (autorisation délivrée d’après le JO, sous la
responsabilité de l’ARS, aux centres ayant une autorisation de chirurgie
cardiaque, avec une décision médico-chirurgicale collégiale staffée, et
inclusion de tous les patients dans le registre national FRANCETAVI) est passée
de 380 TAVI en 2009 à 2400 en 2011, 3700 en 2013, 6900 en 2015.
Les plus de 15000 patients traités depuis 2013 en France, par FRANCE TAVI, nous apprennent que leur moyenne d’âge est de 83 ans, leur niveau de risque (« euroscore ») décroit au fil des ans. Les TAVI se font de plus en plus sous anesthésie locale, par voie fémorale dans 90% des cas avec un taux de succès de procédure de 98,6 %. La mortalité intra-hospitalière est passée de 4 à 2% ces 2 dernières années, il y a encore 7 % d'hémorragies, 0,6 % de rupture aortique, 16% de pace-makers, un taux de fuite aortique péri-prothétique nettement réduit par les TAVI de dernière génération. Les durées de séjour des patients sont réduites à 6 jours en moyenne avec retour au domicile sans convalescence.
Le TAVI révolutionne la prise en charge du rétrécissement aortique, ces
avantages vis à vis de la chirurgie sont évidents. Les indications vont sans
doute encore s’étendre, les études sont en cours. En parallèle, ce traitement
ouvre la perspective à d'autres traitements percutanés, on pense bien sûr à la
valve mitrale et à la valve tricuspide.