Dysglobulinémie monoclonale
Professeur Christian ROSE
Service d’Onco-hématologie du centre Hospitalier Saint Vincent, LILLE
On parle d’immunoglobuline monoclonale (Ig) devant la découverte dans le sérum et/ou les urines d’une Ig caractérisée par un seul type de chaîne lourde et un seul type de chaîne légère, parfois incomplète et représentée seulement par sa chaîne lourde ou légère.
La découverte systématique d’une immunoglobuline monoclonale est une situation médicale fréquente (1 % de la population générale), notamment chez le sujet âgé (5% des patients âgés de plus de 70 ans). Sa présence dans le sang confirme l’existence d’un clone lymphoplasmocytaire ou plasmocytaire au niveau du tissu hématopoïétique (moelle ou ganglions).
La démarche médicale consiste à éliminer une hémopathie maligne, en particulier un myélome multiple. Cependant, monoclonalité n’est pas synonyme de malignité et un certain nombre de patients présentent une immunoglobuline monoclonale sans aucune étiologie associée. Ces patients sont dits porteurs d’une Immunoglobuline dite de signification indéterminée (ni maligne, ni bénigne) appelée MGUS pour Monoclonal Gammapathy of undetermined significance. Cependant, chaque année, 1% de ces patients porteurs de MGUS vont présenter une transformation en une hémopathie maligne. Une surveillance clinique et biologique à vie, assurée par le médecin généraliste, est nécessaire.
Confirmation et caractérisation de la gammapathie monoclonale
L’électrophorèse des protides plasmatiques (EPP) permet la détection des gammapathies monoclonales sous la forme d’une bande étroite migrant dans la région des gammaglobulines (figure 1) parfois dans la région des, ou exceptionnellement dans les α2globulines. L’électrophorèse en gel d’agarose est devenue la technique de référence. La quantification du pic est plutôt effectuée sur l’EPP que par dosage pondéral des immunoglobulines. L’immunofixation (figure 2) est indispensable pour confirmer l’existence d’une immunoglobuline monoclonale et pour sa caractérisation (type de chaîne lourde, type de chaîne légère).
Signification des gammapathies monoclonales
Les étiologies des dysglobulinémies monoclonales sont très variées mais peuvent être classées et résumées en trois grands cadres nosologiques : gammapathie monoclonale de signification indéterminée (MGUS), hémopathies malignes, gammapathies associées à une pathologie non lymphoïde (tableau 1). La fréquence respective de ces trois groupes varie énormément en fonction du recrutement (issu d’un service hospitalier d’hématologie ou non ; ou issu de la médecine générale).
1. MGUS
Elles correspondent à plus de 50 % des cas de gammapathies monoclonales. Une MGUS est définie comme une gammapathie monoclonale sans aucun signe clinique ou biologique de myélome, de maladie de Waldenström ou d’une autre hémopathie maligne. Le terme souvent employé de gammapathie monoclonale bénigne doit être abandonné. Les MGUS sont considérées comme des états pré-néoplasiques car une partie d’entre-elles vont évoluer vers un syndrome immunoprolifératif malin B. Le risque évolutif est faible, estimé à 1% par année de suivi.
Les critères diagnostiques de MGUS sont principalement biologiques :
taux du composant monoclonal inférieur à 30 g/l (quelque soit le type d'immunoglobuline)
normalité de l’hémogramme, de la calcémie et de la créatininémie
protéinurie de Bence Jones négative ou inférieure à 300 mg/24 heures
plasmocytose médullaire inférieure à 10 %
absence de lésion osseuse sur les radiologies standards (crâne, humérus, rachis dorsal et lombaire, bassin, fémurs)
suivi évolutif supérieur à 1 an
2. Hémopathies malignes
Les gammapathies monoclonales de type Ig G et Ig A doivent être distinguées des gammapathies monoclonales de type Ig M.
Gammapathies monoclonales Ig G et Ig A
Le principal diagnostic est le myélome multiple. Les critères diagnostiques sont basés sur la plasmocytose médullaire, le taux du composant monoclonal sérique ou urinaire, le taux des immunoglobulines polyclonales et les radiographies osseuses (Cf tableau N°1).
Gammapathie monoclonale Ig M
Le principal diagnostic est la Maladie de Waldenström définie par l’association d’une gammapathie monoclonale Ig M > 5 g/l et d’une infiltration lymphoplasmocytaire.
Les autres hémopathies malignes associées à l’existence d’une gammapathie monoclonale sont résumées dans le tableau 1.

3. Gammapathies monoclonales associées à une pathologie non lymphoïde
Certaines pathologies non lymphoïdes ont été décrites comme favorisant l’apparition de gammapathies monoclonales. Les affections en cause sont principalement de quatre types : infections, maladies auto-immunes, hépatopathies, certains déficits immunitaires.
û Infections
Toutes les infections (bactérienne : endocardite, ostéomyélite, salmonellose ; parasitaire et surtout virale) peuvent être associées à l’existence d’une gammapathie monoclonale. Les infections aiguës sont habituellement responsables de gammapathies monoclonales transitoires. En revanche, les infections chroniques peuvent être responsables de gammapathies monoclonales permanentes. Trois virus ont un rôle privilégié : EBV, CMV (gammapathies monoclonales transitoires) et VIH (gammapathies monoclonales permanentes). Le virus de l’hépatite C est également fréquemment associé à l’existence d’une gammapathie monoclonale pouvant avoir une activité de type cryoglobulinémie.
û Hépatopathies chroniques
Toutes les hépatopathies chroniques, quelle qu’en soit l’étiologie (nutritionnelle, auto-immune, virale, toxique…), peuvent s’accompagner d’une gammapathie monoclonale.
û Maladies auto-immunes
La pathologie la plus souvent en cause est le syndrome de Goujerot-Sjögren primitif.
û Déficits immunitaires
Un déficit immunitaire primitif ou acquis peut être associé à une gammapathie monoclonale.
Prise en charge
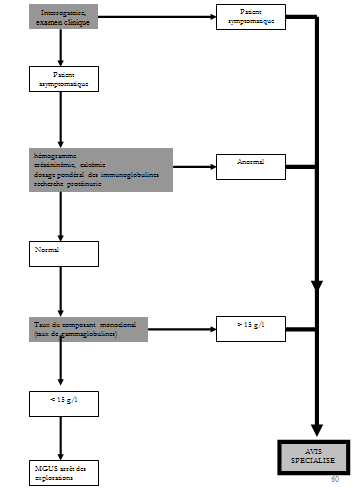
Les critères les plus importants pour la prise en charge sont : le caractère symptomatique ou pas, le type de gammapathie monoclonale, le taux d’immunoglobuline monoclonale, l’âge du patient. Une prise en charge simplifiée est résumée dans la figure N°1.
I) Lorsque le patient est symptomatique, un avis spécialisé est toujours nécessaire. La prise en charge peut parfois être urgente. L’enquête étiologique est orientée par la clinique et le type du composant monoclonal :
è Ig G, Ig A, chaînes légères urinaires : penser en priorité à un myélome multiple
è Ig M : Maladie de Waldentröm, lymphome malin non hodgkinien
Il est indispensable d’éliminer rapidement un myélome (examens complémentaires tableau N°2) en raison : des complications potentiellement graves lors de cette affection et l’existence de mesures thérapeutiques efficaces.
Un certain nombre de manifestations cliniques et biologiques doivent immédiatement faire évoquer un myélome multiple
Signes osseux : douleurs inflammatoires, fractures pathologiques
Anomalies de la numération formule, anémie, neutropénie, thrombopénie
Altération de l’Etat Général
Insuffisance rénale
Hypercalcémie (déshydratation, constipation, vomissements, confusion)
D’autres manifestations orientent immédiatement vers une hémopathie
Adénopathies, splénomégalie
Organomégalie
Anomalies de la numération formule, anémie, thrombopénie, lymphocytose excessive
Syndrome d’hyperviscosité
II) Chez un patient asymptomatique et dont l’examen clinique est normal, la distinction entre MGUS et hémopathie maligne est parfois difficile. Le bilan étiologique doit comporter en première intention en plus de l’électrophorèse des protéines sanguines :
Hémogramme
Calcémie
Créatininémie
Dosage pondéral des immunoglobulines
Recherche d’une protéinurie et caractérisation par immunofixation en cas de positivité
L’enquête étiologique est ensuite poursuivie en fonction du type d’immunoglobuline monoclonale et du taux du composant monoclonal et de l’âge du patient.
si le taux du composant monoclonal Ig G, Ig A ou Ig M est inférieur à 15 g/l :
Aucune enquête complémentaire n’est nécessaire dans l’immédiat si tous les examens précédents sont négatifs. Une consultation d’hématologie est à programmer chez tous les patients jeunes < 50 - 70 ans (limite d’âge non clairement définie).
si le taux du composant monoclonal Ig G ou Ig A est supérieur à 15 g/l :
Consultation d’hématologie et myélogramme
Bilan radiologique osseux : (crâne face + profil, rachis complet face + profil, bassin, extrémités supérieures des humérus et fémurs de face, gril costal). La scintigraphie osseuse n’a aucune place dans ces circonstances (fréquence des faux négatifs).
si le taux du composant monoclonal Ig M est supérieur à 15 g/l :
Biopsie ostéo-médullaire
Scanner abdominal
Chez le patient asymptomatique sans anomalie au bilan étiologique ci-dessus, les gammapathies de signification indéterminée dominent. Plus le patient est âgé, plus le pic est de faible importance, plus la probabilité de découvrir une hémopathie maligne est faible voir nulle.

Comment surveiller un patient porteur d’une MGUS dysglobulinémie dite de signification indéterminée ?
Un certain nombre de patients, totalement asymptomatiques, pourront évoluer secondairement en un authentique myélome ou en une autre hémopathie (lymphome, maladie de Waldenström, leucémie lymphoïde chronique, amylose).
Le risque de transformation pour ces patients est de 1 % par année de suivi. La probabilité de progression cumulative est de 25 % à 20 ans et 35% à 30 ans de suivi.
Les facteurs les plus prédictifs d’une transformation en une hémopathie sont le type d’Immunoglobuline monoclonale (risque élevé pour Ig A et Ig M par rapport à Ig G) et le taux de l’immunoglobuline monoclonale (risque élevé pour taux > à 15 g/l). Un rapport Kappa/ lambda anormal est également prédictif (en cours d’évaluation).
Une surveillance clinique régulière (douleurs osseuses, palpation des aires ganglionnaires, du foie et de la rate) et biologique (numération formule, urée, créatinine, calcémie, électrophorèse des protéines) est nécessaire à vie. La répétition de l’immunofixation n’est pas nécessaire.
La surveillance sera moindre chez un sujet très âgé avec taux d’Ig faible et plus « serrée chez un sujet jeune avec un taux d’Ig élevé. Il est important d’obtenir une notion évolutive et toute franche augmentation (supérieure à 50%) du composant monoclonal nécessite une surveillance plus rapprochée. A l’inverse, une gammapathie monoclonale transitoire ne nécessite pas de contrôle.
BIBLIOGRAPHIE :
Ifrah N, Zandecki M. Gammapathies de signification indéterminée. Rev Prat. 2006 Jan 15;56(1):18-24.
Lopez J, Dauwalder O, Joly P, Dimet I, Bienvenu J, Bernon H.. Intérêt et limites du dosage des chaînes libres dans le sérum et les urines pour le diagnostic et le suivi des gammapathies monoclonales. Ann Biol Clin (Paris). 2006 Mai;64(3):287-97.
Decaux O, Avet-Loiseau H, Grosbois B. Transformation maligne des Gammapathies monoclonales de signification indéterminée. Presse Med. 2007 Dec;36:1985-1996.
Decaux O, Rodon P, Ruelland A, Estepa L, Leblay R, Grosbois B. Epidémiologie des gammapathies monoclonales dans un hôpital général et un service universitaire. Rev Med Interne. 2007 Oct;28(10):670-6.
Figure 1 : Electrophorèse des protides sériques : pic dans la région des gammaglobulines.
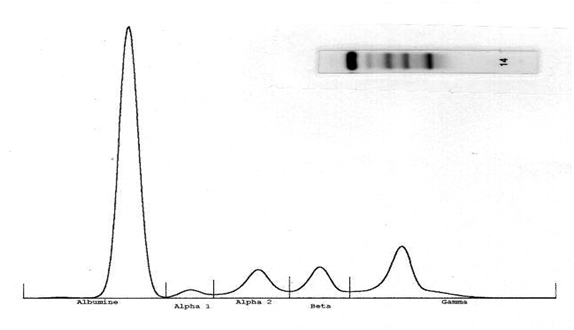
Figure 2 : immunofixation
2A : immunofixation normale
2B : présence d’une gammapathie monoclonale Ig G lambda

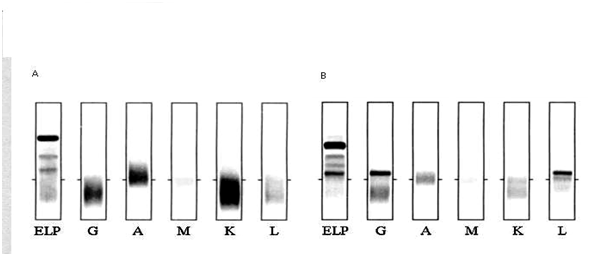
Figure 3 : Algorithme décisionnel devant une gammapathie monoclonale.