Rhumatismes inflammatoires chroniques : actualisation
Rhumatisme Inflammatoire chronique : Actualisation
De l’arthrite au diagnostique
Formathon 2019
Dr Nicolas SEGAUD
Rhumatologue - CH ARMENTIERES
I. Introduction :
Le terme de "rhumatisme" utilisé depuis l'Antiquité, et qui vient du mot grec "reuma" (ῥεῦμα) qui signifie "fluxion", rassemble tous les états pathologiques, douloureux ou non, de mécanisme complexe intéressant une ou plusieurs régions articulaires, avec ou sans épanchement intra-articulaire, et par extension, il intéresse également les régions péri-articulaires : capsules, aponévroses, tendons, ligaments. C'est dire le flou qui caractérise ce terme. Au VIe siècle av JC, Hippocrate décrit notamment une pathologie rhumatismale inflammatoire à savoir la goutte. Bien qu’initialement le terme était descriptif « podagra » (du grec « pris par le pied ») l’orientation s’est fait en suite sur la théorie des humeurs largement reprise par Galien qui intégra la goutte dans son système des 4 humeurs.
Ainsi même si de nos jours la médecine moderne a permis de cadrer pour bonne partie la nosologie des « rhumatismes », il existe dans l’esprit profane une grande confusion face à ce terme parfois qualifié de mot valise.
L’objectif de cette présentation est de permettre au médecin généraliste d’avoir l’esprit clair et synthétique sur l’arbre diagnostique face à l’élément clinique qu’est l’arthrite récente. Dans un second temps nous rappellerons les critères diagnostiques principaux rhumatismes inflammatoires chroniques que sont la polyarthrite rhumatoïde, la spondyloarthrite et le rhumatisme psoriasique. En dehors de notre premier objectif, les autres étiologies inflammatoires microcristallines, infectieuses, connectivite, vascularites ou autres ne seront pas approfondies. De même la prise en charge thérapeutique sera limitée à la prise en charge au sein du cabinet de médecine générale.
II. Mise en évidence de l’arthralgie ou de l’arthrite.
a. Phase diagnostique
Il est nécessaire de rappeler des différences dans les définitions des signes et symptômes :
· épanchement articulaire : état pathologique d’une articulation témoin d’une souffrance intra articulaire d’origine diverse.
· arthralgie : douleur de l’articulation dont il convient de définir l’horaire notamment
· arthrite : inflammation articulaire à point de départ de la synovial dont il convient de définir le nombre (2 à 3 : oligoarthrite, au moins 4 : polyarthrite)
· synovite : épaississement et inflammation de la membrane synoviale
L’épanchement articulaire peut se définir cliniquement par l’inspection et la palpation. Cependant des examens complémentaires peuvent parfois être nécessaire pour des formes frustes ou infracliniques ou encore pour les articulations profondes comme la hanche.
Quand un épanchement est détecté, différents éléments sont importants à recueillir :
· le contexte médical : hémophilie chez un enfant, traitement anticoagulant, chondrocalcinose articulaire connue chez un sujet âgé… ;
· son ancienneté (récent, chronique) ;
· son importance ;
· l’existence de signes locaux inflammatoires ;
· l’existence d’un épaississement de la membrane synoviale (synovite), qui est palpable surtout dans la polyarthrite rhumatoïde (pannus rhumatoïde).
Un épanchement articulaire ne doit pas être confondu avec :
· un hygroma (ou bursite) ou une ténosynovite qui sont la conséquence d’une atteinte des structures péri-articulaires ;
· une lésion cutanée inflammatoire, en particulier un érysipèle ;
· une lésion tumorale ostéoarticulaire (rare).
b. Démarche diagnostique
i. L’interrogatoire
Au delà du recueil des antécédents et de l’anamnèse, l’interrogatoire du patient doit s’attarder à définir 3 questions clé devant un tableau de douleur articulaire : depuis quand, où et comment.
La douleur peut être récente ou chronique (plus de 6 semaines). Une douleur récente est le plus souvent aiguë, mais il existe des formes à début progressif avec des douleurs initiales très modérées.
L’analyse du nombre, de la topographie, de l’existence de signe rachidien sont des éléments prépondérants pour l’orientation nosologique.
Enfin le médecin doit s’attarder à définir la nature mécanique ou inflammatoire (voir parfois mixte) de la plainte algique.
Tableau 1 : Comparaison douleur mécanique / inflammatoire
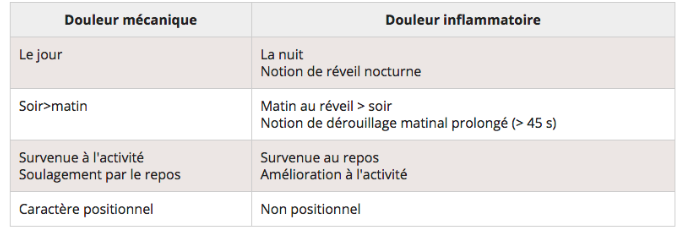
ii. Examen physique
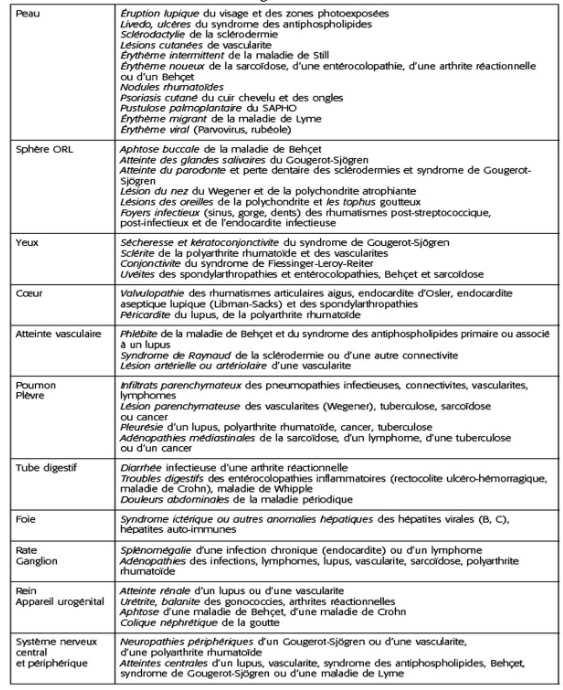
Au delà de la dimension rhumatologique, avec notamment la qualification de l’atteinte articulaire, la déformation, l’estimation de la plainte algofonctionnelle, l’examen physique doit s’attarder sur l’examen extra rhumatologique à la recherche d’une origine étiologique. Un examen minutieux et systémique doit être réalisé. Celui-ci est bien repris dans le Tableau 2 issu du site du COFER (Collège Français de Enseignants en Rhumatologie)
http://campus.cerimes.fr/rhumatologie/enseignement/rhumato38/site/html/cours.pdf
Tableau 2 : Signes cliniques extra rhumatologiques
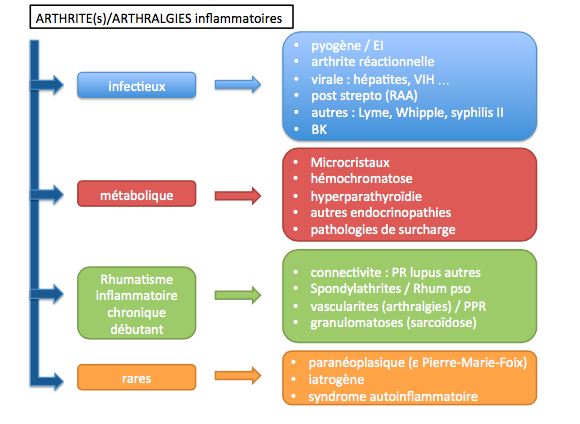
c. Étiologies
Au terme de l’examen clinique, une orientation étiologique est indispensable pour le médecin généraliste qui devra décider dans son cabinet de la suite de la prise en charge : poursuite des investigations en externe (biologie, imagerie), orientation vers une consultation spécialisée en ville, orientation vers une hospitalisation ainsi que du degré d’urgence à y apporter. On notera comme principale difficulté souvent la réalisation de la ponction articulaire qui est la pierre angulaire de la prise en charge quand elle est réalisable.
On rappellera que l’origine infectieuse est la première étiologie à évoquer devant un tableau de monoarthrite aigue ou d’une polyarthrite fébrile.
d. Bilan paraclinique
Bien entendu le bilan paraclinique de biologie et d’imagerie sera dépendant et orienté par l’examen clinique et l’orientation étiologique.
L’analyse du liquide articulaire est un bilan majeur quand il est réalisable avec la recherche de la cellularité (>2000 éléments/mm3pour l’inflammatoire), des cristaux et surtout de la microbiologie (direct, cultures aérobie/anaérobie, sérologie, PCR…)
i. Bilan biologique :
Le bilan est forcément plus ou moins exhaustif en fonction du choix personnel du médecin généraliste dans l’orientation prise pour son patient. En gras, les élément que je trouve nécessaire sur un bilan de « débrouillage » :
· NFS
· VS, CRP
· Prélèvements bactériologiques :
o Hémocultures en cas de suspicion d'arthrites septiques
o Si urétrite ou quand on soupçonne une arthrite gonococcique ou réactionnelle : prélèvements urétraux (cervicaux/vaginaux chez la femme) à la recherche d'un gonocoque ou d'un chlamydia
o Sérologies infectieuses : Elles sont demandées en fonction du contexte : anticorps anti-streptococciques (suspicion de RAA) : ASLO, antistreptodornases.
o sérologie VIH
o sérologie de l'hépatite B et sérologie de l'hépatite C
o sérologie du parvovirus V19
o sérologie de la borréliose de Lyme
o suspicion d'arthrites réactionnelles : sérologie de salmonellose, de yersiniose, de chlamydia (peu fiable)
· Bilan immunologique :
o Facteur rhumatoïde
o Anticorps anti-nucléaires (AAN)
o ACPA ou Ac anti CCP
o ANCA
o Anticorps antiphospholipides
o C3, C4, CH50
o EPS
o cryoglobuline
· Autres examens diagnostiques :
o Uricémie
o Biologie hépatique
o Bilan rénal
o Bilan phosphocalcique, Bilan martial
o enzymes musculaires (CPK, LDH, aldolase)
o Recherche de l'antigène HLA B27, gène HFE, MEFV…
Pour les plus motivés, quelques informations complémentaires sur le bilan immunologique :
· Le FR est recherché historiquement par le test du latex et la réaction de Waaler-Rose. Les seuils de positivité sont respectivement de 1/80ème et 1.64ème. Le FR n'est ni constant, ni spécifique d'une affection donnée.Actuellement, la détection du FR par néphélométrie laser (technique automatisable exprimée en unités) ou par technique ELISA est la plus répandue et la plus sensible (seuil : 20 UI/mL).
Le FR peut être présent dans de nombreuses affections : polyarthrite rhumatoïde (50 % des cas dans les premiers mois d'évolution), lupus érythémateux disséminé (20 %), syndrome de Gougerot-Sjögren (65 %), connectivite mixte (50 %), hépatites chroniques (VHC, auto-immune), endocardite d'Osler (50 %), cryoglobulinémies (80 %).
· La recherche d'AAN se fait par immunofluorescence indirecte (IFI) sur hépatocytes de rat et/ou sur cellules HEp-2. Le seuil de positivité est habituellement de 1/80. La présence d'AAN n'est ni spécifique, ni constante d'une maladie, mais oriente fortement vers une connectivite. Les AAN peuvent être positifs dans le LED (96 %), le syndrome de Sharp (100 %), la sclérodermie systémique (75 %), le syndrome de Gougerot-Sjögren primitif (50 %), la PR (25 %), des dermatopolymyosites (50 %).
· La recherche d'anticorps anti-ADN natif a un grand intérêt pour le diagnostic de LED. Trois méthodes peuvent être utilisées : IFI sur Crithidia luciliae, méthode ELISA, test de Farr (méthode radio-immunologique). Les anticorps anti-ADN natif sont présents dans 80 % des LED et sont spécifiques du LED.
o Les anticorps dirigés contre les antigènes nucléaires solubles (anti-ECT ou anti-ENA) ont des spécificités différentes :
o anti-Sm : spécifiques du LED (5 à 8 %)
o anti-U1 RNP : connectivites mixtes (100 %), LED (40 %)
o anti-SSA (anti-Ro) : LED (30 %), syndrome de Gougerot-Sjögren primitif (50 %)
o anti-SSB (anti-La) : syndrome de Gougerot-Sjögren (50 %)
o anti-Scl 70 (anti-topoisomérase I) : spécifiques des sclérodermies généralisées (20 %)
o anti-JO1 (antisynthétase) : spécifique des polymyosites (20 %)
· La recherche des anti-centromères est nécessaire dès que l'on suspecte une sclérodermie du type CREST syndrome (présents dans 60 à 80 % des cas).
· Anticorps anti-cytoplasme des polynucléaires neutrophiles : les ANCA
Ce sont des auto-anticorps dirigés contre des enzymes lysosomales leucocytaires. La détection en IF distingue les c-ANCA (fluorescence classique diffuse) et les p-ANCA (fluorescence périnucléaire). La positivité de la détection justifie la détermination de leur spécificité antigénique : anti-protéinase 3 (anti-PR3), anti-myélopéroxydase (anti-MPO). Les ANCA sont présents essentiellement dans des vascularites systémiques. Schématiquement :
o des c-ANCA anti-PR3 sont presque spécifiques de la maladie de Wegener (90 % des formes diffuses)
o des p-ANCA anti-MPO peuvent être présents dans diverses affections, surtout la PAN microscopique (environ 60 %), et le syndrome de Churg et Strauss (20 %).
ii. Bilan d’imagerie
Devant une oligo/polyarthrite récente, les radiographies articulaires sont le plus souvent normales ou ne montrent que des signes témoignant du gonflement des parties molles ou d'un épanchement. Des lésions ostéo-articulaires destructrices apparaissant précocement doivent faire rechercher avant tout une cause septique. En effet, dans les rhumatismes inflammatoires chroniques destructeurs (PR et rhumatisme psoriasique notamment), les lésions radiologiques apparaissent généralement après plusieurs mois d'inflammation articulaire.
Le bilan comprendra :
· des articulations siège des arthrites : radiographies bilatérales et comparatives
· si on soupçonne une PR : radiographies des mains et poignets (face) et des avant-pieds (face)
· si on soupçonne une spondyloarthrite : radiographie du bassin et éventuellement centrées sur les sacro-iliaques, rachis lombaire prenant la charnière dorsolombaire (F+P)
· si on soupçonne une chondrocalcinose articulaire (CCA) : mains + poignets (F), bassin (F), genoux (F+P).
· une radiographie de thorax (sarcoïdose, vascularite, préthérapeutique)
En fonction de la clinique, le bilan pourra être complété par une échographie, scanner (de l’articulation/TAP), IRM (de l’articulation, rachis, sacro iliaque) voir un TEP (vascularite, PPR de diagnostique difficile, néoplasie…)
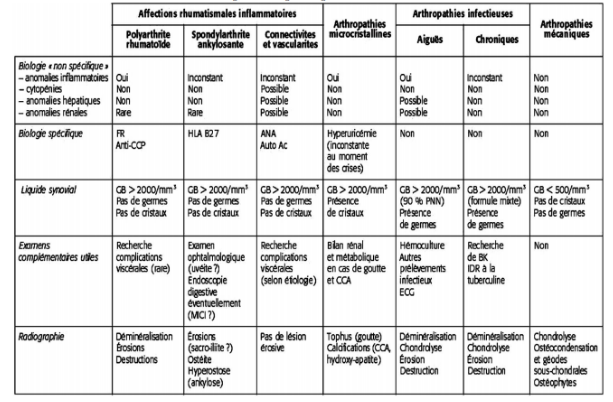
Vous trouverez dans le tableau 3 les caractéristiques des principales formes d’atteintes articulaires issu du site du COFER (Collège Français de Enseignants en Rhumatologie)
http://campus.cerimes.fr/rhumatologie/enseignement/rhumato38/site/html/cours.pdf
Pour en savoir plus :
Boyer BF, Cantagrel A. Arthrite d’évolution récente. Rev Prat. 200 ;57 :2051-9
CarliP et al. Polyarthralgies et polyarthrites au début. Diagnostics difficiles en médecine interne 2008 :766-779
Tableau 3 : Caractéristiques des principales formes d’atteintes articulaires
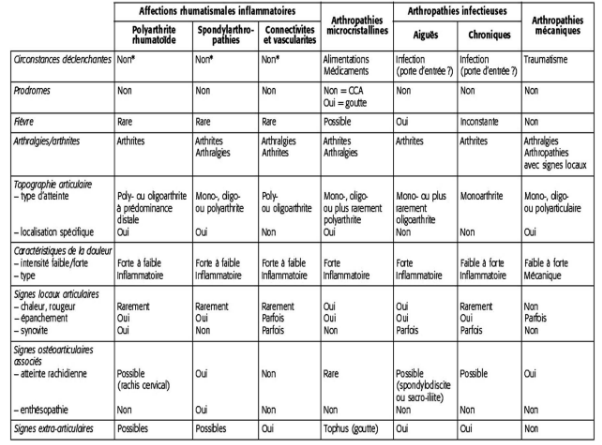
III. Polyarthrite rhumatoïde
a. Présentation clinique
La polyarthrite rhumatoïde est le plus fréquent des rhumatismes inflammatoires chroniques (prévalence estimée entre 0,3 et 0,8 % de la population adulte). L'âge moyen du début est cinquante ans mais elle peut débuter précocement entre quinze et trente ans ou tardivement après soixante-dix ans. La polyarthrite rhumatoïde est trois fois plus fréquente chez la femme avant soixante ans mais cette différence de sex-ratio s'atténue progressivement au-delà de soixante-dix ans.
A la phase initiale qui correspond à notre topo, le schéma initial le plus fréquent est celui d’une polyarthrite bilatérale symétrique et nue (sans signe extra articulaire sans érosion).
Il conviendra de se méfier d’autre manifestions plus rare :
· polyarthrite aigue fébrile
· atteinte rhizomélique
· atteinte monarticulaire (poignet / genou) ou simple ténosynovite
· rhumatisme intermittent avec poussée résolutive en 24-48h
· forme cachexiante
La PR est une maladie systémique qui doit faire rechercher des atteintes extra rhumatologiques (nodule, syndrome interstitiel, syndrome sec notamment).
b. bilan paraclinique
Nous ne reviendrons pas sur ce qui a été défini plus haut. Rappelons simplement que dans le bilan immunologique la positivité du FR et des Ac anti CCP est hautement en faveur du diagnostique.
Pour autant concernant le FR, sa spécificité est de 75 à 85 % et sa sensibilité de 70 à 80%. Ainsi chez le sujet sain < à 50 ans la positivité est de 5% et chez le patient sain > à 70 ans sa positivité est de 15%. Le FR est également retrouvé dans d’autres connectivites mais également en cas de syndrome inflammatoire chronique, d’hémopathie (Waldenstrom , LLC) ou d’affections diverses (sarcoïdose, cirrhose…).
Les ACPA ou anti CCP sont un groupe d’anticorps anti peptides citrullinés. Lorsque ce dosage est positif, il permet de prédire avec une spécificité supérieure à 95 % le diagnostic de polyarthrite rhumatoïde mais il peut cependant être retrouvé positif dans d'autres maladies inflammatoires (par exemple, chez 5 % des syndromes de Gougerot-Sjögren).
Le bilan radiographique +/-échographique doit être réalisé dès le début à la recherche d’érosions dont la présence à la phase initiale de la maladie est un facteur de mauvais pronostique.
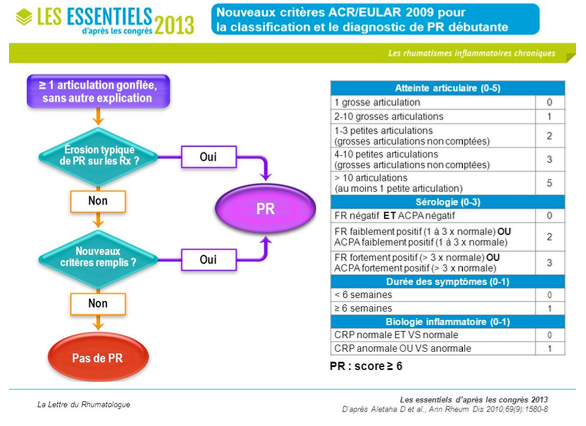
c. critères diagnostique de classification
Il existe des critères de classification définis par un travail conjoint entre les sociétés savantes américaines et européennes en 2009. Ces critères permettent d’orienter sur la mise en place d’un traitement de fond par méthotrexate. Bien qu’il s’agisse initialement de critères de classification, leur utilisation depuis presque 10 ans ont montré leur caractère robuste et sont utilisés en routine actuellement.
Tableau 4 : Critères ACR/ EULAR PR
d. prise en charge thérapeutique
i. Traitement symptomatique
Encore une fois, il ne sera abordé dans ce chapitre uniquement ce qui est applicable par le médecin généraliste à son cabinet. Le choix des différents immunosuppresseurs, immunomodulateurs ou biothérapie n’est pas abordé.
Le repos est préconisé uniquement en cas de poussée inflammatoire de la maladie. Les traitement antalgiques de niveau I ou associations de niveau II sont à adaptés aux patients.
Le traitement par AINS doit être introduit en théorie en 1èreintention avant 65 ans, la corticothérapie étant réservée aux patients de plus de 65 ans en 1ere intention ou en cas d’échec des AINS. La corticothérapie doit être à posologie faibleentre 5 et 10mg par jour (0,1mg/kg/j). Le sevrage doit être planifié dès le départ.
La mise en route de la corticothérapie doit être associée à une évaluation du risque d'ostéoporose : facteurs de risque cliniques, antécédents de fracture, mesure de la densité osseuse, correction de la carence en vitamine D (recommandation du GRIO de l’ostéoporose cortico induite http://www.grio.org/documents/page500/boite-a-outils-osteoporose500-1415788202.pdf)
Les ponctions évacuatrices-infiltrations de dérivés cortisoniques ont un effet local important pour compléter le traitement général.
ii. Traitement de fond
Les recommandations orientent sur prise en charge spécialisée par un rhumatologue. Cependant en l’absence des contre indications, de projet de grossesse … le choix se porte sur le méthotrexate. Le CRI (club du rhumatisme inflammatoire branche de la Société Française de rhumatologie) a réalisé :
· une fiche pré thérapeutique du MTX
(http://cri-net.com/ckfinder/userfiles/files/fiches-pratiques/MTX-Dec2016/MTX_01.pdf)
· une fiche d’initiation
(http://cri-net.com/ckfinder/userfiles/files/fiches-pratiques/MTX-Dec2016/MTX_01.pdf)
· une fiche de suivi
(http://cri-net.com/ckfinder/userfiles/files/fiches-pratiques/MTX-Dec2016/MTX_03.pdf)
IV. Spondyloarthrite
a. Présentation clinique
Le concept de spondyloarthrite (SpA anciennement appelée spondylarthropathie) regroupe des rhumatismes inflammatoires chroniques qui partagent certaines de leurs manifestations cliniques ainsi qu'un terrain génétique commun. En font partie la spondylarthrite ankylosante, le rhumatisme psoriasique, les arthrites réactionnelles, les arthrites associées aux entérocolopathies inflammatoires et les SpA indifférenciées ou spondyloarthrite.
La terminologie et description des spondyloarthrites ont changé avec les critères de classification européens ASAS. Une nouvelle terminologie a été proposée, permettant de décrire au mieux le phénotypage clinicoradiographique d'un patient atteint de spondyloarthrite (SpA).
· Spondyloarthrites axiales (SpA axiales) :
o Radiographiques = avec sacro-iliite radiographique = spondylarthrite ankylosante (SA)
o Non radiographiques = sans sacro-iliite radiographique
· Spondyloarthrites périphériques articulaires(SpA périphériques) :
o Érosives
o Non érosives
· Spondyloarthrites périphériques enthésitiques (SpA enthésitiques)
Afin de mieux caractériser le phénotype de l'atteinte, on peut ajouter les éventuelles manifestations articulaires concomitantes. Par exemple : spondyloarthrites axiales non radiographiques avec uvéite antérieure ; spondyloarthrites périphériques articulaires non érosives avec psoriasis, etc.
La prévalence globale de l'ensemble des spondyloarthrites est de 0,35 % en France, le sex-ratio étant de 1,5 (hommes/femmes). La majorité des cas débute chez l'adulte jeune (avant trente-cinq ans ou quarante ans).
Les manifestations cliniques des spondyloarthrites combinent de façon variable :
· un syndrome pelvirachidien ou axial (atteinte rachidienne et sacro-iliite) ;
· un syndrome enthésopathique ;
· un syndrome articulaire périphérique ;
· un syndrome extra-articulaire (uvéite, psoriasis, balanite, uréthrite, diarrhée, entérocolopathie inflammatoire)
b. bilan paraclinique
Nous ne reviendrons pas sur ce qui a été défini plus haut.
Il est nécessaire d’insister sur le génotypage HLA B27 comme facteur prédisposant. HLA-B27 qui est un allèle normal du complexe majeur d'histocompatibilité (CMH) est très fortement associé avec la spondylarthrite ankylosante (il s'agit de l'une des plus fortes associations actuellement connues entre un antigène du système HLA et une maladie, avec un risque relatif [RR] supérieur à 200). La prévalence d'HLA-B27 dans la population générale caucasienne est de 6 à 8 %. Elle est exceptionnelle chez les sujets à peau noire où sa présence est un élément sémiologique encore plus élevé. La prévalence d'HLA-B27 parmi les malades atteints de spondylarthrite ankylosante est supérieure à 90 %, de 63 à 75 % parmi les malades souffrant d'arthrite réactionnelle ou de syndrome de Reiter, de 50 à 70 % pour le rhumatisme psoriasique et les rhumatismes associés aux entérocolopathies inflammatoires.
La radiographie conventionnelle est un élément clé. Des clichés spécifiques des sacro iliaques doivent être prescrits en plus des clichés habituels. La positivité des radiographies standard (sacroiliites radiographiques, enthésites vertébrales) permet de retenir le diagnostic de spondylarthrite ankylosante.
En cas de négativité, un bilan complémentaire par une IRM des sacro iliaques +/- IRM du rachis dorsolombaire doit être demandé.
c. critères diagnostique de classification
a. Spondyloarthrite de forme axiale
Pour retenir le diagnostique devant un patient de moins de 45 ans présentant des douleurs du rachis évolutives depuis plus de 3 mois soit :
· le patient répond au bras imagerie :
o Radio + : spondylarthtite ankylosante (critère de NY modifié)
o Radio – IRM Sacro-iliaque + : spondyloarthrite de forme axiale
· le patient répond au bras biologique : HLA B27 +
Tableau 5 : Critères ASAS 2009 SpA forme Axiale

Tableau 6 : Critères de New York modifié de SA (spondylarthrite ankylosante)

b. Spondyloarthrite de forme périphérique
Pour retenir le diagnostique devant un patient une arthrite, une dactylite ou une enthésite :
Tableau 7 : critères diagnostiques SpA forme périphériques

d. prise en charge thérapeutique
La prise en charge thérapeutique que cela soit pour la forme axiale ou périphérique repose sur l’utilisation en 1ere intention d’AINS.
En cas d’échec ou de forme sévère d’emblée, un traitement de fond pourra être indiqué (biothérapie dans les formes axiales, traitements synthétiques dans les formes périphériques). Le patient devra alors être adressé auprès d’un rhumatologue.
Le traitement symptomatique et rééducatif doit être adapté au patient.
V. Rhumatisme psoriasique
e. Présentation clinique
L'incidence est de 6 pour 100 000 par an et est maximale entre 30 et 55 ans. Le sex-ratio est de 1 et sa prévalence serait de 0,12 % (probablement sous-estimée). L'âge de début semble habituellement plus tardif par rapport aux autres spondyloarthrites. Chez les patients souffrant de psoriasis cutané (environ 2 % de la population générale), la fréquence des manifestations ostéoarticulaires inflammatoires est estimée entre 5 et 25 %.
Les études familiales suggèrent une prédisposition associée aux antigènes HLA. Les associations avec HLA Cw*0602 et B17 semblent dépendre de la présence de psoriasis cutané. Le HLA-B27, qui est moins fréquemment rencontré que dans les autres spondyloarthrites, est associé à l'atteinte axiale.
Il existe plusieurs formes de présentation clinique :
· forme périphérique
o soit de type polyarthrite séronégative symétrique ou asymétrique (diffuse, destructrice avec atteinte tripolaire du doigt)
o soit de type mono ou oligoarticulaire asymétrique (grosses articulations ou les orteils ou doigts avec un aspect en saucisse)
· forme axiale ou spondyloarthrite psoriasique (20 à 40 % des cas)
· formes rares
o forme mutilantes mains et pieds
o onycho pachydermo periostite
o orteil de BAUER
o présentation enthésopathique pure
Bien entendu le diagnostic est plus facile en présence d’un psoriasis cutané associé. La distribution des signes cutanés est très variable d'un patient à l'autre. 90 % ont un psoriasis qui est préexistant dans environ 75 % des cas ou synchrone des manifestations articulaires dans 10 à 15 % des cas. Il faut savoir rechercher des antécédents familiaux de psoriasis.
f. bilan paraclinique
Il n’y a pas de bilan biologique spécifique en dehors de l’HLA B 27 qui peut éventuellement orienter notamment en cas de forme axiale.
Le bilan radiographique doit être réalisé et adapté à la situation clinique (radio standard, échographie +/- IRM).
En cas de doute clinque dermatologique le patient sera adressé en consultation spécialisée pour réalisation d’un biopsie cutanée.
g. critères diagnostique de classification
Les critères de classification CASPAR sont ceux habituellement le plus utilisés.

h. prise en charge thérapeutique
La prise en charge thérapeutique est très variable en fonction de la forme de présentation. Par ailleurs par certains aspects les recommandations françaises, européennes ou internationale sont parfois différentes.
Le traitement par antalgiques et AINS peut bien sûr être mise en place. Il faut veiller au facteur de risques cardiovasculaires souvent associés chez les patients présentant un psoriasis. La corticothérapie doit par contre être évitée en 1ere intention si le patient présente une forme cutanée notamment si celle-ci est au 1erplan (risque d’effet rebond ou d’érythrodermie).
Les traitements de fond synthétiques (méthotrexate, salazopyrine, léflunomide) ou les biothérapies (anti TNF aplha, anti IL17 ou anti JAK) doivent être introduits sur consultations spécialisées idéalement sur concertation pluridisciplinaires entre rhumatologues et dermatologues.
VI. Conclusion
Les rhumatismes inflammatoires sont de classification parfois difficile. L’orientation doit se faire après un examen clinique et paraclinique rigoureux pour éviter les errances diagnostiques et des pertes de chances pour le patient. Le travail doit se faire sur un partenariat entre le médecin traitant et son confrère rhumatologue référent pour une prise en charge optimale.